研究交流
発生期および成体における肝幹・前駆細胞の増殖・分化誘導機構
紙谷聡英
東京大学・医科学研究所・幹細胞治療分野
1.はじめに
肝臓形成は、その初期に腸管の一部(前腸)が、心筋細胞や横中隔細胞からのシグナルによって肝芽へと分化することから始まる。胎生期の肝幹・前駆細胞(肝芽細胞、hepatoblast)は、高い増殖能と肝細胞・胆管上皮細胞への二方向の分化能を持つ細胞である。近年、肝芽細胞に特異的に発現する表面抗原マーカーの研究が精力的に行われ、Dlk、E-cadherin、Liv2、CD13、CD133などが同定されている(1-4)。これらの表面抗原に対する特異的抗体とフローサイトメーター(FACS)を用いた細胞分画により、胎仔期の肝臓に存在する肝芽細胞を高度に純化し培養することが可能になった(図1)。Suzukiらは、CD29+CD49flowc-Kit-CD45-Ter119-細胞をコラーゲン等の細胞マトリクス上に低密度で播種し増殖因子存在下で培養することで、1細胞から増殖し100以上の細胞からなる大型のコロニーを形成できる非常に増殖性の高い細胞を同定し、H-CFU-Cと名づけた(5)。
肝臓における再生は他の再生臓器(血液や皮膚など)と異なり、幹細胞ではなく成熟した機能細胞である肝細胞が一時的に増殖能を獲得して行う。肝細胞の増殖を抑制するような強い肝障害等では、肝幹細胞から分化した肝前駆細胞(oval細胞等)が増殖し再生に関与すると考えられていが、正常な成体肝臓における肝幹・前駆細胞については未だ不明な点が多い。本総説では、胎生期および成体における肝幹・前駆細胞の純化・培養法やその性状について、我々の研究報告を中心に紹介する。
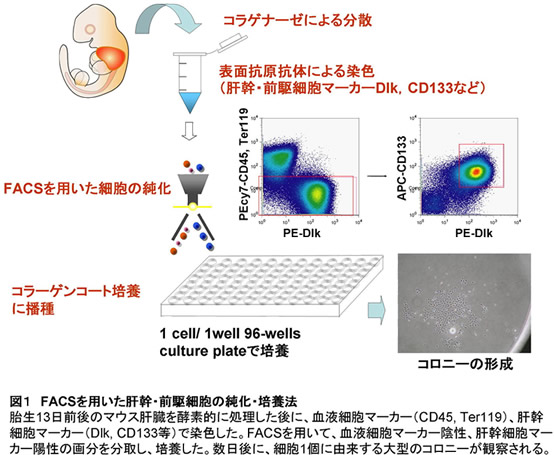
2.胎生肝臓の肝幹・前駆細胞を制御する転写因子群
Prox1は発生段階から成体肝細胞まで継続して発現する転写因子であり、その遺伝子欠損は肝臓の形成異常を示す(6)。ノックアウトマウスの研究から、肝発生初期の肝芽の横中隔領域へのmigrationにProx1が必須なことが明らかとなっている。我々は、肝幹・前駆細胞の増殖等におけるProx1の機能を解析するために、強制発現誘導系を用いて解析を行った(7)。マウス胎生13日の肝臓より肝幹・前駆細胞(CD45-Ter119-Dlk+細胞)をFACSを用いて純化し、コラーゲンコート上で低密度培養した。この際、コントロールまたはProx1発現レトロウイルスを感染させ強制発現を行った結果、Prox1発現によって細胞のScatteringに加えて、増殖能が亢進することを見出した。一方、Prox1と結合してその活性を抑制することが報告されているLrh1を肝幹・前駆細胞に強制発現した結果、その増殖抑制が見られた。Prox1はcdk inhibitorであるp16ink4aのプロモーター領域の活性を抑制し、逆にLrh1によってプロモーター活性上昇が見られることから、p16ink4aの発現調節を通じて、Prox1とLrh1が競争的に肝幹・前駆細胞の増殖能を制御していると考えられる。
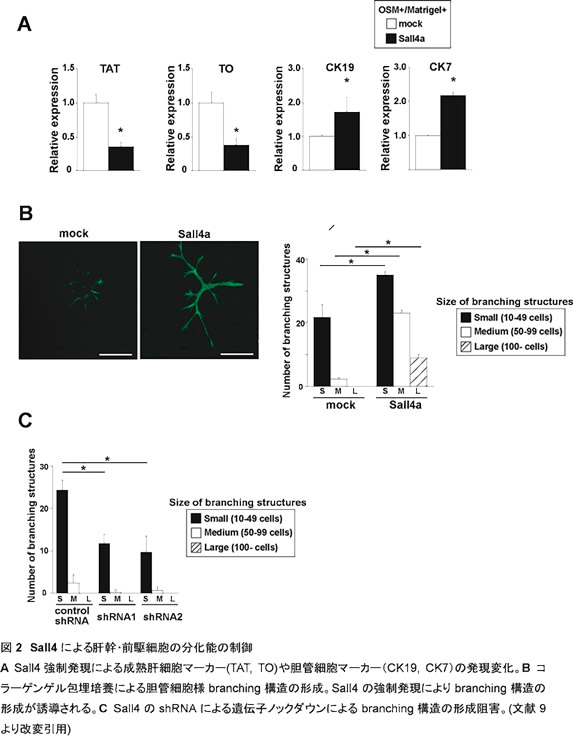
Sall4は、ショウジョウバエからヒトまで保存されているZincフィンガー型転写因子であるSallファミリーに属する転写因子である。Sall4のヒトホモログは、眼球運動異常や四肢、心臓等の形成異常を呈するOkihiro症候群の原因遺伝子である一方で、一部の急性骨髄性白血病(acute myelogenous leukemia)等の癌細胞に発現することが報告されていた(8)。我々は、ヒトhepatoma細胞株(Huh7、HepG2)や胎生期の肝幹・前駆細胞でSall4が発現することを見出し、肝発生におけるSall4の機能について解析を行った(9)。以前より我々は、オンコスタチンMおよび細胞外マトリクス添加によるin vitro肝成熟化誘導系を構築している(10, 11)。そこで、肝幹・前駆細胞にレトロウイルスを用いてマウスSall4遺伝子を強制発現させた状態で肝成熟を誘導した結果、成熟肝細胞のマーカー遺伝子であるtyrosine aminotransferase (TAT)やtryptophan oxygenase (TO)の発現抑制が観察された。一方で、cytokeratin (CK) 19やCK7といった胆管細胞のマーカー遺伝子の発現誘導が見られた。さらに、コラーゲンゲル包埋培養によるin vitroでの胆管細胞様branching構造の誘導を行った結果、Sall4の強制発現によりbranching構造の形成が促進された。逆にSall4をsmall hairpin RNA (shRNA)を用いてノックダウンすると、branching構造の形成阻害が観察された(図2)。以上の結果から、Sall4は肝幹・前駆細胞の肝細胞や胆管細胞の分化決定に関与している転写因子と考えられた。
また、同様に肝細胞の増殖・分化を制御する転写因子としてSuzukiらはTbx3を同定している(12)。Tbx3は、発生期肝臓では肝幹・前駆細胞画分に特異的に発現する転写因子であり、そのノックアウトマウス胎仔では肝臓の低形成が見られる。そこで、Tbx3ノックアウトマウス由来の肝幹・前駆細胞でコロニーアッセイを行った結果、Tbx3欠損細胞では野生型に比べて著しく細胞の増殖能が低下していること、その増殖抑制がp19arfの発現誘導を通じて生じていることを報告している。p19arfの強制発現では、細胞の増殖抑制に加えて胆管細胞マーカーCK7の発現誘導が見られることから、Tbx3は肝幹・前駆細胞の増殖・分化を制御する転写因子と考えられる。
以上のように、発生過程での肝幹・前駆細胞の機能を制御する転写因子群については様々な解析が行われているが、その詳細な発現制御ネットワークは未だ不明な点も多い。最近、遺伝子発現における転写因子等による制御に加えて、micro RNA(miRNA)による転写後制御の重要性が報告されている。我々は、純化した胎仔肝由来肝幹・前駆細胞と成体肝細胞を用いてmiRNAの網羅的発現解析を行った結果、複数のmiRNA群が肝幹・前駆細胞で特異的に発現することを見出している(未発表)。転写因子に加えてmiRNAによる肝発生制御の分子メカニズムの同定が今後進むと考えられる。
3.成体肝臓由来肝前駆細胞の純化とクローナル培養系の構築
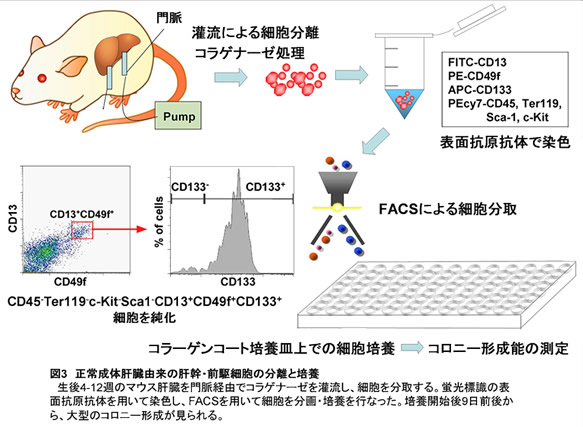
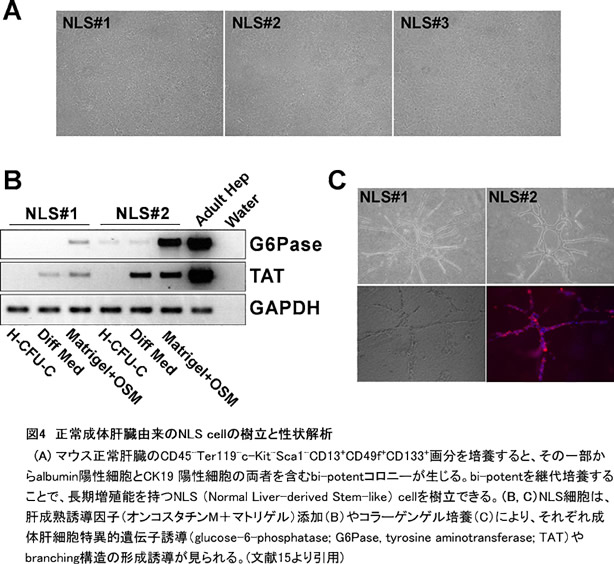
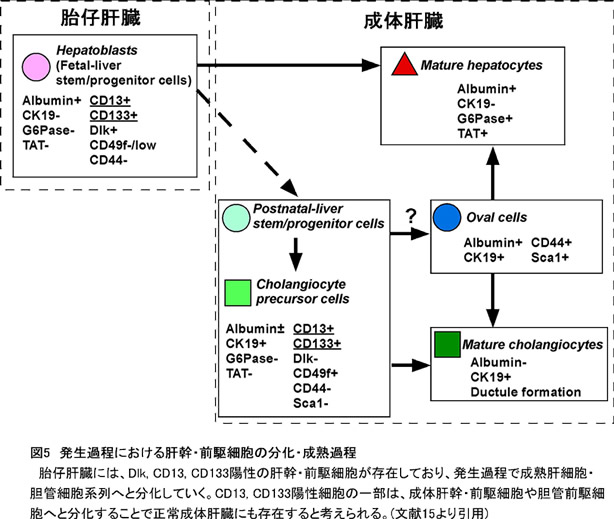
成熟肝細胞の増殖が阻害されるような重篤な肝障害において、肝前駆細胞の増殖等が見られることが既に報告されている。最近、正常な成体肝臓中のEp-CAM陽性細胞が高い増殖能などを持つ肝前駆細胞であることが報告された(13, 14)。我々は、胎仔期肝幹細胞のマーカー遺伝子であるCD13およびCD133の陽性細胞が、成体肝臓の非実質細胞画分に存在することを見出した(15)。そこで、このCD13+CD133+細胞をFACSにより純化しクローナルに培養した結果、その一部が大型でalbumin陽性細胞とCK19陽性細胞からなるコロニーを形成できるbi-potent progenitor cellであることを見出した(図3)。この肝幹細胞由来のコロニーは、継代培養することで細胞株に近い長期増殖が可能であり、NLS (Normal Liver-derived Stem-like) cellと名づけた。NLS cellは、オンコスタチンMや細胞外マトリクスの刺激により成熟肝細胞特異的遺伝子の発現を誘導できる。またコラーゲン包埋培養によってbile-ductal-likeなbranching構造を形成することから、成熟肝細胞・胆管細胞への二方向性分化能を持つ(図4)。さらに、NLS cellを再度clone-sortingを行なっても、albumin, CK19両陽性のコロニーを形成できる自己複製能を保持していた。以上の結果から、正常肝臓のCD45-Ter119-c-Kit-Sca1-CD13+CD49f+CD133+画分に、肝幹・前駆細胞が存在すると考えている(図5)。
4.まとめ
肝幹・前駆細胞のクローナルな培養系の確立によって、発生段階の肝幹・前駆細胞の増殖・分化誘導メカニズムや成体での肝幹・前駆細胞に関する様々な知見がここ最近報告されている。しかし現在の肝幹・前駆細胞単独の培養系では、一部の遺伝子発現が生体での機能を模倣していない等の問題点も徐々に明らかになりつつある。我々は、肝幹・前駆細胞とフィーダー細胞との共培養を行うことで、これらの問題点を解決する新規培養系の構築を現在進めている。肝幹細胞の幹細胞活性維持に重要な分子メカニズムの同定が、今後の重要な研究課題になると考えている。
最後に、本稿を書く機会を与えていただきました、塩尻信義先生および第17回肝細胞研究会会長の榎本克彦先生に深く感謝いたします。図の一部については、Gastroenterology誌に掲載された図を許可の上、転載・改変しております。感謝いたします。この研究は、様々な先生方との共同研究・ご指導のもと、東京大学医科学研究所・幹細胞治療分野(中内啓光教授)にて行いました。この場を借りまして、お礼を申し上げます。
参考文献
- Nitou, M., Sugiyama, Y., Ishikawa, K., and Shiojiri, N. (2002) Purification of fetal mouse hepatoblasts by magnetic beads coated with monoclonal anti-e-cadherin antibodies and their in vitro culture. Exp Cell Res 279,330-343
- Tanimizu, N., Nishikawa, M., Saito, H., Tsujimura, T., and Miyajima, A. (2003) Isolation of hepatoblasts based on the expression of Dlk/Pref-1. J Cell Sci 116,1775-1786
- Watanabe, T., Nakagawa, K., Ohata, S., Kitagawa, D., Nishitai, G., Seo, J., Tanemura, S., Shimizu, N., Kishimoto, H., Wada, T., et al. (2002) SEK1/MKK4-mediated SAPK/JNK signaling participates in embryonic hepatoblast proliferation via a pathway different from NF-kappaB-induced anti-apoptosis. Dev Biol 250,332-347
- Kakinuma, S., Ohta, H., Kamiya, A., Yamazaki, Y., Oikawa, T., Okada, K., and Nakauchi, H. (2009) Analyses of cell surface molecules on hepatic stem/progenitor cells in mouse fetal liver. J Hepatol 51,127-138
- Suzuki, A., Zheng, Y., Kondo, R., Kusakabe, M., Takada, Y., Fukao, K., Nakauchi, H., and Taniguchi, H. (2000) Flow-cytometric separation and enrichment of hepatic progenitor cells in the developing mouse liver. Hepatology 32,1230-1239
- Sosa-Pineda, B., Wigle, J.T., and Oliver, G. (2000) Hepatocyte migration during liver development requires Prox1. Nat Genet 25,254-255
- Kamiya, A., Kakinuma, S., Onodera, M., Miyajima, A., and Nakauchi, H. (2008) Prospero-related homeobox 1 and liver receptor homolog 1 coordinately regulate long-term proliferation of murine fetal hepatoblasts. Hepatology 48,252-264
- Ma, Y., Cui, W., Yang, J., Qu, J., Di, C., Amin, H.M., Lai, R., Ritz, J., Krause, D.S., and Chai, L. (2006) SALL4, a novel oncogene, is constitutively expressed in human acute myeloid leukemia (AML) and induces AML in transgenic mice. Blood 108,2726-2735
- Oikawa, T., Kamiya, A., Kakinuma, S., Zeniya, M., Nishinakamura, R., Tajiri, H., and Nakauchi, H. (2009) Sall4 regulates cell fate decision in fetal hepatic stem/progenitor cells. Gastroenterology 136,1000-1011
- Kamiya, A., Kinoshita, T., Ito, Y., Matsui, T., Morikawa, Y., Senba, E., Nakashima, K., Taga, T., Yoshida, K., Kishimoto, T., et al. (1999) Fetal liver development requires a paracrine action of oncostatin M through the gp130 signal transducer. EMBO J 18,2127-2136
- Kamiya, A., Kojima, N., Kinoshita, T., Sakai, Y., and Miyaijma, A. (2002) Maturation of fetal hepatocytes in vitro by extracellular matrices and oncostatin M: induction of tryptophan oxygenase. Hepatology 35,1351-1359
- Suzuki, A., Sekiya, S., Buscher, D., Izpisua Belmonte, J.C., and Taniguchi, H. (2008) Tbx3 controls the fate of hepatic progenitor cells in liver development by suppressing p19ARF expression. Development 135,1589-1595
- Schmelzer, E., Zhang, L., Bruce, A., Wauthier, E., Ludlow, J., Yao, H.L., Moss, N., Melhem, A., McClelland, R., Turner, W., et al. (2007) Human hepatic stem cells from fetal and postnatal donors. J Exp Med 204,1973-1987
- Okabe, M., Tsukahara, Y., Tanaka, M., Suzuki, K., Saito, S., Kamiya, Y., Tsujimura, T., Nakamura, K., and Miyajima, A. (2009) Potential hepatic stem cells reside in EpCAM+ cells of normal and injured mouse liver. Development 136,1951-1960
- Kamiya, A., Kakinuma, S., Yamazaki, Y., and Nakauchi, H. (2009) Enrichment and clonal culture of progenitor cells during mouse postnatal liver development in mice. Gastroenterology 137,1114-1126










