研究交流
小型魚類メダカを用いた肝形成および肝疾患研究
仁科 博史
東京医科歯科大学難治疾患研究所
1. はじめに
発生期の肝形成は、幹細胞である肝芽細胞が内胚葉由来の前腸から発生することに始まる。肝芽細胞は増殖を繰り返した後、胆管上皮細胞や成熟肝細胞へ分化・成熟する。in vitro 組織培養系の進歩や多数のノックアウトマウスの作出によって、肝形成に関与する遺伝子やシグナル伝達系が明らかになりつつある。しかしながら、母胎内の子宮で発生するマウス胚を用いた肝臓発生研究には様々な困難が伴う(図1)。それ故、母胎外で発生し、上記の問題を克服できる新たなモデル生物が求められている。本稿では,器官形成やヒト疾患のモデル生物として最近注目されている小型魚類(ゼブラフィッシュやメダカ)を用いて行われている肝形成および肝疾患に関する研究の現状を、我々の研究を中心に紹介する。
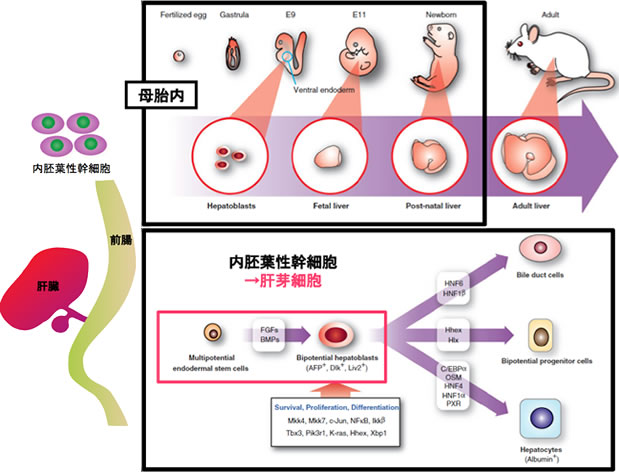
図1 マウスの肝発生
母マウスの体内にある子宮内でマウス胚は発生する。胎仔肝はマウス胚の体内に形成される器官である。
肝幹細胞(肝芽細胞)は内胚葉性幹細胞から発生し、肝臓構成細胞へと分化・成熟する。
2. 小型魚類を用いて肝形成を研究する利点
ゼブラフィッシュやメダカは、1)卵生で胚が透明であるため、肝形成の過程を生きたまま経時的に観察できる(生きたまま分子や細胞のイメージングが可能)(図2)、2)細胞移植等の胚操作ができる、3)モルフォリノアンチセンスオリゴ (MO)を用いた遺伝子ノックダウンの機能阻害実験ができる、4)体もゲノムサイズも小さく、飼育スペースや経費が節約できるため、突然変異体の大規模スクリーニングが可能である、5)マウスでは血管や造血の形成不全の結果、肝形成以前に致死あるいは2次的に肝形成に影響が及ぶ場合があるが、小型魚類の胚体は小さいため、循環器系の障害による酸素不足を回避でき、独立した事象として肝形成を観察できる、6)初期の造血が血島と腎臓で行われるために、発生中の肝臓に障害が生じても貧血症が生じないなど、マウス胚での問題点を解決し得る特徴がある1)。一方、マウスでは胚性幹(ES)細胞を用いた遺伝子破壊によって、ノックアウトマウスの作出が容易になっているが、小型魚類では特定遺伝子破壊実験はまだ一般的には普及していない。TILLING法2)やZinc Finger Nuclease法3)など有望な技術の改良と普及によって、ノックアウトゼブラフィッシュやノックアウトメダカの作出が容易になることが期待されている。
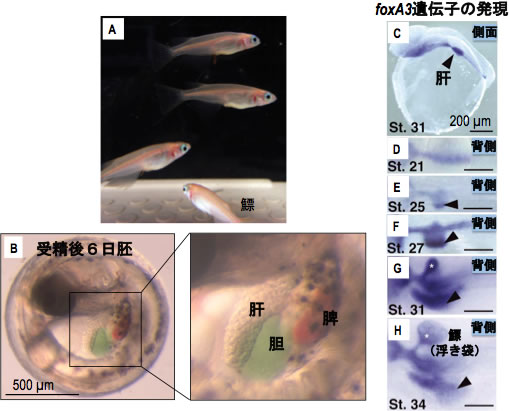
図2 メダカの肝発生
メダカ胚は母体外で発生する。メダカ胚は透明であるため、実体顕微鏡下で、肝臓を含む器官を観察可能である。
3. ゼブラフィッシュを用いた肝形成研究
ゼブラフィッシュのゲノムサイズ1700 Mbは、ヒトやマウスの半分であり、全塩基配列の決定プロジェクトや大規模な変異体スクリーニングなど研究環境の整備が進んでいる。特に1990年代にはドイツのチュ-ビンゲンとアメリカのボストンの2ケ所で数百に及ぶ変異体が単離され、現在までに器官形成に関わる重要な遺伝子が明らかにされた実績がある4)。消化器系に異常を来すゼブラフィッシュ変異体も複数単離されており、そのうち肝形成に関与するものとしては、肝臓の細胞死を呈するbeefeaterなど10種類以上が存在する5, 6)。Stainierらのグループは、全ての内胚葉でgreen fluorescent protein (GFP) が発現するトランスジェニック系統を確立し、この系統を用いて、肝臓の出芽形成や形態など詳細な観察と記述を報告しているほか、この系統を用いて内胚葉形成異常変異体のスクリーニングを行っている7)。Wargaらは、胚操作の容易さを活用して1細胞レベルで予定肝臓領域を含む内胚葉予定運命図の作製を進めているなど多岐に渡る研究が行われている8)。また最近になって、宮脇らのグループは、細胞周期の進行を生きたまま可視化できるfluorescent ubiquitination-based cell cycle indicator (Fucci)を開発した9)。細胞周期G1 期の細胞核は赤色、S/G2/M期の細胞核は緑色の蛍光を発するので、増殖中の細胞と休止期の細胞を同時に区別して可視化できる。彼らはFucciを全身に発現するトランスジェニックゼブラフィッシュの作出にも成功した10)。最新の遺伝学や遺伝子工学を駆使した解析が無脊椎動物のショウジョウバエや線虫で行われているが、脊椎動物のゼブラフィッシュを用いた研究もこれらに近づきつつある。
4. メダカを用いた肝形成研究
日本産のモデル生物であるメダカは、1)ゲノムサイズが800 Mbであり、ゼブラフィッシュの半分であること、2)メラニン色素を欠失している系統が存在し、胚発生後期においても胚が透明で観察しやすいこと(透明メダカ)、3)性染色体が確定していること(ヒト同様に性決定はXYシステム)、さらに4)生育温度幅が広く(14~34℃)温度感受性変異体の単離も可能であるなど、ゼブラフィッシュにない特性を有する。メダカも全ゲノム配列の解読やゲノムライブラリの作製がほぼ完了し、今後数年以内に研究環境は十分に整備されると期待されている11)。このようなゲノムサイズや形態の特徴から、メダカの利点を活かした変異体の単離が期待されている。
大阪大学教授の近藤寿人を代表とするERATO近藤誘導分化プロジェクト(1998~2003年)が京都の鴨川のほとりに立ち上がり、国内外の約10の研究グループが集結し、メダカを用いた大規模スクリーニングが行われた。上述したゼブラフィッシュでは単離できなかったユニークな変異体も多数単離された12)。我々のグループは、先ずメダカの肝発生の解析を行い、次に肝形成および肝機能異常変異メダカのスクリーニングを行った13)。メダカの肝臓は、胚発生の進んだ孵化直前の胚においても体軸の左側の卵黄上に存在しており、体のほぼ中心に位置するゼブラフィッシュに比較して観察しやすい (図2B)。内胚葉マーカーの1つであるfoxA3 (hnf3g) をプローブとし、胚発生に従って経時的に in situ ハイブリダイゼーションを行った結果から、1) メダカの肝発生は、発生段階を示すStage (St.) 25 (2日胚、血流開始直後) 頃に体軸の左側から肝臓原基が出芽すること、2) 桿状に集まった内胚葉細胞から肝臓が形成する過程は“突出期 (st. 25- 31)”と“成長期 (st. 31~)”の大きく2段階に分けられること、3) 突出期の後期には肝臓原基と腸管との間が分離し始め、徐々に両者の接点が限局されていくこと、4) 肝臓原基は次第に大きく成長して肝臓としての形態を獲得し、肝特異的な遺伝子の発現を開始することが明らかとなった(図2C-H)。次に肝形成における形態変化と機能獲得の双方に着目し、複数の方法を用いてメダカ変異体のスクリーニングを行い、肝形成や肝機能不全変異体を複数単離することに成功した。得られた19種の変異体は、その表現型から5つのグループ(第1群:肝芽形成不全変異体、第2群:肝臓低形成変異体、第3群:肝臓位置異常変異体、第4群:胆嚢色異常変異体、第5群:脂質代謝異常変異体)に分類された (図3)14, 15)。
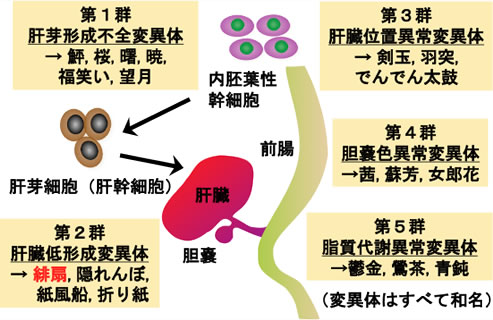
図3 肝形成不全および肝機能不全メダカ変異体の単離
アルキル化剤N-ethyl-N-nitrosourea
(ENU)を用いて点変異を導入されたメダカ変異体である。
肝形成不全と肝機能不全の観点から5群に分類された。
このうち第2群に属する“緋扇(hiohgi) ”と命名した変異体(胚の形が扇子に似ている)は、“肝臓が小さく、胸鰭が無い”という興味深い表現型を示す。原因遺伝子の同定から、ビタミンAからオールトランスレチノイン酸(RA)を合成する酵素(レチノイン酸合成酵素タイプ2, RALDH2)をコードする遺伝子の変異であることが判明した。詳細な解析から、側板中胚葉(lateral plate mesoderm)に発現するRALDH2がRAを産生し、下流に位置するWnt2bb遺伝子の発現を誘導し、肝臓の特異化を決定することが示された(図4A)。興味深いことに、このRALDH2によるWnt遺伝子誘導のシグナル系は、胸鰭の特異化を決定するシグナル系と酷似している(図4B)。マウス前脚(ヒトの上肢に相当)およびゼブラフィッシュの胸鰭にRALDH2が必須の役割を果たし、その下流にWntやTbxのシグナル分子が存在することはこれまでに示されてきたが、いずれの変異体も肝形成以前に致死となり、RALDH2の肝形成における役割については不明のままであった。hiohgiメダカ変異体の解析によって初めてRALDH2の肝特異化の役割が明らかとなった。ゼブラフィッシュ変異体とメダカ変異体をうまく比較検討することの大切さを教えられる16)。
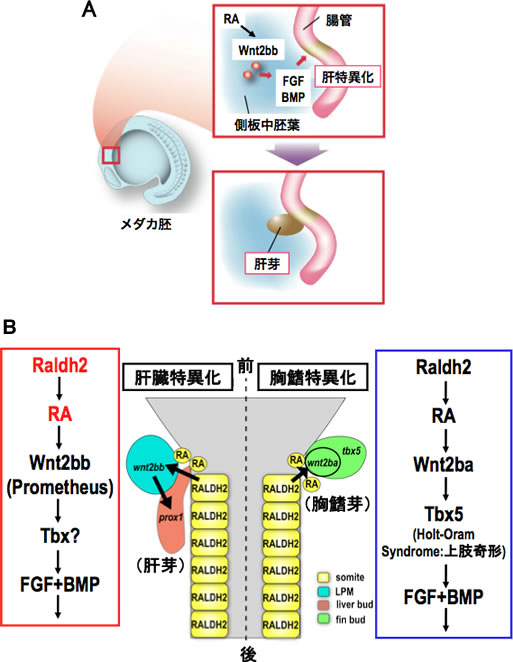
図4 メダカの肝特異化と胸鰭特異化を制御するシグナル伝達系
A. メダカの肝特異化シグナル伝達系を示す。
B.メダカ肝特異化シグナル伝達系と胸鰭特異化シグナル伝達系は類似している。
5. メダカを用いた肝疾患モデルの作出
Sadlerらは変異体スクリーニングによって脂肪肝ゼブラフィッシュ“foie gras ”を単離した17)。我々も生後60~80日で脂肪肝になる“kendama”メダカ変異体の単離に成功している(図5)。また、高脂肪食をメダカに摂取させることによって、非アルコール性脂肪性肝炎(NASH)を発症させることにも成功している18)。ヒトと類似の病理所見や遺伝子発現の変化が観察された。興味深いことに、多価不飽和脂肪酸であるEPAの同時投与によってNASHの発症は抑制された。欧米では既に小型脊椎動物ゼブラフィッシュを用いたハイスループット薬剤スクリーニングが行われている。マウスに比較して、スクリーニングできる薬剤の数は百倍以上、繁殖や飼育にかかる実験費用も数十分の1以下という利点がある。それ故、ヒト疾患を模倣する変異体の単離が注目されている。脂肪肝を前段階として、線維化、NASH、肝硬変、肝癌へと病態を悪化させる場合があり、重篤な肝疾患を予防する方法の一つとして、脂肪肝を軽減させることが有効と考えられる。kendamaメダカ変異体や高脂肪食摂取によるNASH様メダカを用いた脂肪肝発症機構の解明と創薬研究が期待されている。
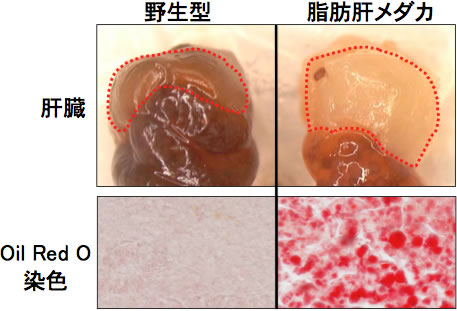
図5 脂肪肝メダカkendama
kendama変異体は生後6週目ぐらいから脂肪の蓄積が観察される。生後8週目の脂肪肝を示す。
6. まとめ
小型魚類のメダカやゼブラフィッシュは、ヒトやマウスと同じ脊椎動物であり、対応する多くの器官が存在する。またその形成に関わる分子メカニズムは種間を越えて保存されている。代謝器官である肝臓の形成メカニズムも本稿で紹介したように、メダカ、ゼブラフィッシュ、マウス、ヒトでほぼ同じである。今後は、ノックアウトマウスを用いた肝形成の研究に加えて、メダカやゼブラフィッシュ変異体を用いた研究が本領域に貢献すると考えられる。我が国では、ヒト疾患と創薬を見据えた医学薬学研究に貢献するモデル生物はマウスやラットより高等な生物という意識が根強いが、「メダカはりっぱな肝臓病のモデル動物である」ことを肝細胞研究会の皆さんには理解して頂きたい!
最後に本稿を書く機会を与えて頂きました塩尻信義先生に感謝致します。メダカ変異体スクリーニングは、科学技術振興事業団ERATOプロジェクトの近藤寿人先生(大阪大学教授)と古谷—清木誠先生(英国バス大学主任研究員)のご指導のもと行われました。高脂肪食による脂肪肝メダカの作出は、山口大学医学部の坂井田功教授と寺井崇二講師との共同研究です。お世話になった多くの先生方にこの場を借りて感謝いたします。
7. 文献
- Chu J, Sadler KC. New School in Liver Development: Lessons from Zebrafish. Hepatology 50, 1656-1663, 2009.
- Moens CB, Donn TM, Wolf-Saxon ER, Ma TP. Reverse genetics in zebrafish by TILLING. Brief Funct Genomic Proteomic. 7, 454-459, 2008.
- Doyon Y, McCammon JM, Miller JC, Faraji F, Ngo C, Katibah GE, Amora R, Hocking TD, Zhang L, Rebar EJ, Gregory PD, Urnov FD, Amacher SL. Heritable targeted gene disruption in zebrafish using designed zinc-finger nucleases. Nat Biotechnol. 26, 702-728, 2008.
- Zebrafish Special Issue. Development 123, 1-461, 1996.
- Chen JN, Haffter P, Odenthal J, Vogelsang E, Brand M, van Eeden FJ, Furutani-Seiki M, Granato M, Hammerschmidt M, Heisenberg CP, Jiang YJ, Kane DA, Kelsh RN, Mullins MC, Nüsslein-Volhard C. Mutations affecting the cardiovascular system and other internal organs in zebrafish. Development 123, 293-302, 1996.
- Pack M, Solnica-Krezel L, Malicki J, Neuhauss SC, Schier AF, Stemple DL, Driever W, Fishman MC. Mutations affecting development of zebrafish digestive organs. Development 123, 321-328, 1996.
- Field HA, Ober EA, Roeser T, Stainier DY. Formation of the digestive system in zebrafish. I. Liver morphogenesis. Dev Biol. 253, 279-290, 2003.
- Warga RM, Nüsslein-Volhard C. Origin and development of the zebrafish endoderm. Development 126, 827-838, 1999.
- Sakaue-Sawano A, Kurokawa H, Morimura T, Hanyu A, Hama H, Osawa H, Kashiwagi S, Fukami K, Miyata T, Miyoshi H, Imamura T, Ogawa M, Masai H, Miyawaki A. Visualizing spatiotemporal dynamics of multicellular cell-cycle progression. Cell 132, 487-498, 2008.
- Sugiyama M, Sakaue-Sawano A, Iimura T, Fukami K, Kitaguchi T, Kawakami K, Okamoto H, Higashijima SI, Miyawaki A. Illuminating cell-cycle progression in the developing zebrafish embryo. Proc Natl Acad Sci U S A 106, 20812-20817, 2009.
- Kasahara M, Naruse K, Sasaki S, Nakatani Y, Qu W, Ahsan B, Yamada T, Nagayasu Y, Doi K, Kasai Y, Jindo T, Kobayashi D, Shimada A, Toyoda A, Kuroki Y, Fujiyama A, Sasaki T, Shimizu A, Asakawa S, Shimizu N, Hashimoto S, Yang J, Lee Y, Matsushima K, Sugano S, Sakaizumi M, Narita T, Ohishi K, Haga S, Ohta F, Nomoto H, Nogata K, Morishita T, Endo T, Shin-I T, Takeda H, Morishita S, Kohara Y. The medaka draft genome and insights into vertebrate genome evolution. Nature 447, 714-719, 2007.
- Medaka Special Issue. Mech Dev. 121, 593-1008, 2004.
- Watanabe T, Asaka S, Kitagawa D, Saito K, Kurashige R, Sasado T, Morinaga C, Suwa H, Niwa K, Henrich T, Hirose Y, Yasuoka A, Yoda H, Deguchi T, Iwanami N, Kunimatsu S, Osakada M, Loosli F, Quiring R, Carl M, Grabher C, Winkler S, Del Bene F, Wittbrodt J, Abe K, Takahama Y, Takahashi K, Katada T, Nishina H, Kondoh H, Furutani-Seiki M. Mutations affecting liver development and function in Medaka, Oryzias latipes, screened by multiple criteria. Mech Dev. 121, 791-802, 2004.
- Hata S, Namae M, Nishina H. Liver development and regeneration: from laboratory study to clinical therapy. Dev Growth Differ. 49, 163-170, 2007.
- Nakamura T, Nishina H. Liver development: lessons from knockout mice and mutant fish. Hepatol Res. 39, 633-644, 2009.
- Negishi T, Nagai Y, Asaoka Y, Ohno M, Namae M, Mitani H, Sasaki T, Shimizu N, Terai S, Sakaida I, Kondoh H, Katada T, Furutani-Seiki M, Nishina H. Retinoic acid signaling positively regulates liver specification by inducing wnt2bb gene expression in medaka. Hepatology 2009 Oct 22. [Epub ahead of print]
- Sadler KC, Amsterdam A, Soroka C, Boyer J, Hopkins N. A genetic screen in zebrafish identifies the mutants vps18, nf2 and foie gras as models of liver disease. Development 132, 3561-3572, 2005.
- Matsumoto T, Terai S, Oishi T, Kuwashiro S, Fujisawa K, Yamamoto N, Fujita Y, Hamamoto Y, Furutani-Seiki M, Nishina H, Sakaida I. Medaka as a Novel and Accurate Model for Human Nonalcoholic Steatohepatitis. Disease Models & Mechanisms in press










