研究交流
ヒト間葉系幹細胞を用いた肝再生医療研究
汐田 剛史
鳥取大学大学院医学系研究科 遺伝子医療学部門
はじめに
旺盛な再生能力をもつことが知られる肝臓の再生医学研究は古くて新しい研究領域である。1932年に70%部分肝切除モデルが報告され、実験的な肝再生研究がスタートした。その後、1964年に米国ハーバード大学Bucher教授らによる有名なクロスサーキュレーション実験より、肝再生を促進する液性因子の存在が予見され、その後、初代肝細胞培養技術と蛋白精製技術の発達により、1989年にはわが国の坪内博仁博士、中村敏一博士の二つの研究グループが独立して肝細胞増殖因子(HGF)遺伝子のクローニングを報告した。肝臓領域のみでなく、1990年代後半から再生医学研究が加速している。
再生医療への関心の高さの原因として、再生医療の治療ポテンシャルへの期待がある。臓器不全のみでなく、癌の治療においても癌組織の除去後の組織修復に応用可能であり、単一遺伝子病にも遺伝子導入技術との併用により治療の可能性が見出され、研究自体が困難であった変性疾患に対しても再生医学の技術導入により直接的な研究が可能となりつつある。2007年の京都大学再生医学研究所山中伸弥教授らによるヒトiPS細胞の報告は、ヒト生命の萌芽たる受精卵を使用せず核の初期化を可能とした画期的な発見であった。この報告は科学的事実の報告にとどまらず、再生医療実現へ向けた方向性を明示している。すなわち、ヒトに投与可能な安定で安全な幹細胞の創出と、幹細胞から各細胞へ分化させる技術開発であり、これらを融合することで、真に臨床応用可能な再生医療の実現化へ繋がると期待される。間葉系幹細胞は、肝再生治療に応用可能なセルソースであり、教室で取り組む肝細胞分化誘導研究について概説する。
1. 肝臓のプロジェニターセル
通常の肝障害時には、成熟肝細胞が分裂増殖し、肝再生が行われる。しかし、劇症肝炎や非代償性肝硬変などの重症の肝障害時には、成熟肝細胞の増殖は抑制されており、新たに出現した幹細胞が肝再生を担っていると報告されている。肝臓に出現する幹細胞には、肝臓由来の肝幹細胞と肝臓以外の臓器由来の幹細胞が存在する。肝幹細胞としては、ラットにおいて、アセトアミノフルオレイン(AAF)を投与後、70%部分肝切除時に出現するオーバル細胞が研究されてきた1)。AAFはミクロソームのチトクロームP450で代謝され、DNA合成阻害作用をもつため、成熟肝細胞のDNA合成を抑制する。一方、チトクロームP450が未発達なオーバル細胞では細胞増殖を抑えないため、出現したオーバル細胞は成熟肝細胞に比べ優位に増殖することができる。オーバル細胞は、門脈領域のへリング管から発生した胆管系細胞で、卵円形の形態を有し、核細胞質比が大きく、好塩基性細胞質をもつ。肝細胞と胆管細胞へ分化するbipotentな細胞である。オーバル細胞は、肝障害時に骨髄から遊走し、肝再生に関与するという報告もある2)。
2.移植医療をゴールとする肝再生医療の方向性の明確化
ヒト肝幹細胞に関しての報告はあまりなく、肝幹細胞がどのようにヒトの肝再生を担っているのか明らかではない。しかし、肝幹細胞が劇症肝炎、非代償性肝硬変などの肝不全時にのみに出現するという事実を鑑みると、これらの細胞を患者の肝臓から採取し使用する再生医療は実現性が低いと言わざるを得ない。したがって、肝再生医療の細胞ソースは、肝臓以外の組織幹細胞やiPS細胞に求めるのが妥当と考えられる。
山中らのiPS細胞の報告3、4)は、幹細胞を移植医療に用いる再生医療実現の方向性を示している。現在、再生医療実現化のためのストラテジーは、第一に、ヒトに投与できる安全で安定な幹細胞の創出である。ヒトに用いることのできる幹細胞の条件として、発癌性がない、倫理的問題がない、安定・安全な細胞、染色体に組み込まれるレトロウイルスなどを用いない、導入遺伝子数が少なく、低分子化合物や蛋白質を用いる方法の採用、などが挙げられる。第二には、幹細胞から各種細胞への効率のよい分化誘導法を確立することである。現在の方法はいずれも不十分で不確実である。「ヒトに使用できる安全な幹細胞」の創成技術と、「確実に目的細胞へ分化させる技術」を融合させ、移植医療へ応用する新規の技術開発が、今後求められる再生医療実現化へ向けた研究の方向性である。
3.ヒト骨髄由来および臍帯血由来間葉系幹細胞から機能性肝細胞への分化誘導
近年、間葉系幹細胞はin vitroの条件下で、ある程度の肝機能をもつ細胞に分化しうることが報告された5、6)。すなわち、間葉系幹細胞を種々のサイトカインを添加し、数週間培養し肝細胞様に分化したと報告されている。間葉系幹細胞は骨髄、臍帯血などに存在し、比較的採取が容易である。骨髄は自己細胞を用いることで免疫拒絶反応を回避できる利点がある。また、臍帯血は通常廃棄される細胞であるため、倫理的問題が少ない。以上より、間葉系幹細胞は肝再生医療の有望な細胞ソースと言える。
間葉系幹細胞は一般にライフスパンが短く、in vitroでの長期培養は必ずしも容易ではない。梅澤らはhTERT遺伝子などを導入し、安定に増殖しうるヒト骨髄由来及びヒト臍帯血由来間葉系幹細胞株を樹立した7,8)。これらの細胞は、安定に増殖するが、染色体異常がなく、コンタクトインヒビションが機能し、免疫抑制動物に移植しても腫瘍を形成しない。また、細胞分化に影響しないことから、間葉系幹細胞の分化研究に有用な細胞である。
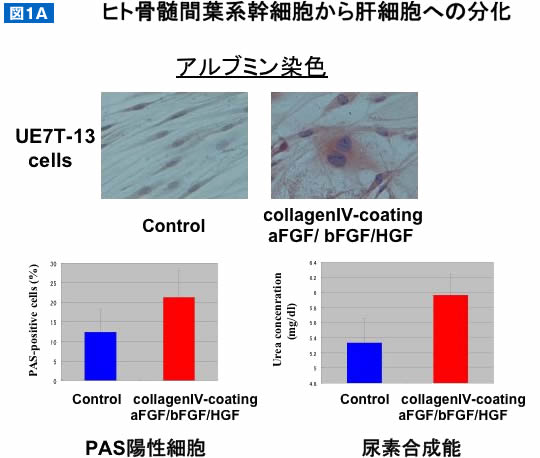
著者らは、ヒト骨髄由来間葉系幹細胞UE7T-13細胞を用いて肝細胞分化を検討した9)。すなわち、5-azacytidine(5-aza)、各種サイトカイン、IV型コラーゲンコートなどを組み合わせた約40種類以上の分化誘導条件でUE7T-13細胞を21日間分化誘導し、アルブミンmRNA発現量を指標として最も発現量の多い条件を検討した。その結果、IV型コラーゲンをコートした培養皿で、aFGF/bFGF/HGFの培養条件が至適 条件であることを見出した(図1A)。この時、線維芽細胞様形態をとるUE7T-13細胞の形態をもつ細胞中から、成熟肝細胞に特徴的な2核をもつ大型の肝細胞様の形態をもつ細胞を誘導できた。アルブミン陽性細胞は約30%に、グリコーゲンを貯蔵するPAS陽性細胞は約21%に増加し、尿素合成能も明らかに増加した。これは、単に肝細胞マーカーを有するのみでなく、機能性肝機能としての能力を持つことを示している。
図1. ヒト間葉系幹細胞から肝細胞への分化
(A)分化誘導条件と肝機能
(B)分化誘導時の遺伝子発現変動
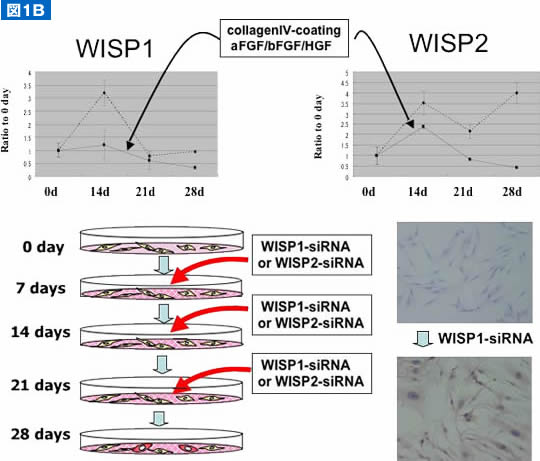
UE7T-13細胞から肝細胞への誘導過程での遺伝子発現の変動を検討するため、誘導開始7日目の遺伝子発現をIV型コラーゲン/aFGF/bFGF/HGFとコントロール群で、DNAマイクロアレイ法およびシグナルアレイにより解析した。その中から著者らは、CCNファミリーに属するWISP1、WISP2に着目した(図1B)。これらの遺伝子は細胞の分化, 増殖に密接に関与すると報告されている。WISP1とWISP2は肝細胞分化誘導過程で発現量が明らかに低下することを認めた。そこで, WISP1とWISP2をsiRNAを用いて発現抑制すると、 IV型コラーゲン/aFGF/bFGF/HGFで分化誘導した場合と同程度の分化誘導効果が得られることが判明した。つまり、WISP1あるいはWISP2の発現抑制はUE7T-13細胞が肝細胞分化誘導されるために重要であることを見出した。WISP1、WISP2は、ともにWnt/β-cateninシグナルの標的遺伝子である。
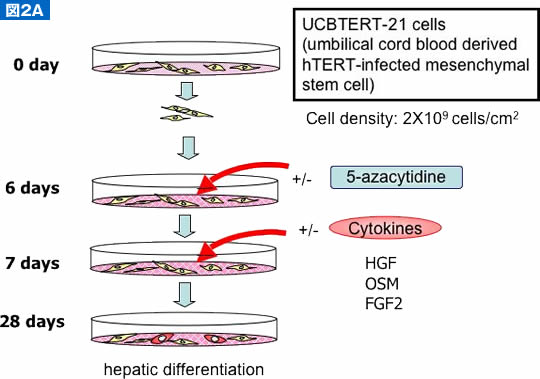
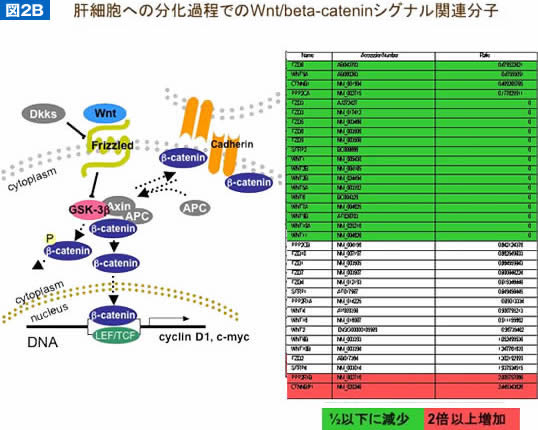
ヒト臍帯血間葉系幹細胞であるUCBTERT-21細胞の肝細胞分化誘導について同様に検討した10)。この場合、まずDNAメチル化阻害剤である5-azaで24時間処理後, HGF/OSM/FGF2添加条件下で最も高いアルブミンmRNA発現量を得た(図2A)。グリコーゲンを有しPAS陽性となる細胞や、尿素合成能が明らかに増加し、機能性肝細胞であることを認めた。UCBTERT-21細胞から肝細胞分化における遺伝子発現変化をDNAマイクロアレイ法により検討すると、Wnt/β-cateninシグナルに関与する遺伝子発現が大きく変動していた(図2B)。すなわち、Wnt/β-cateninシグナルを正に制御する分子は1/2以下に発現が減少するものが多く、対照的にWnt/β-cateninシグナルを負に制御する分子の発現が2倍以上に増加しているものを2分子認めた。以上より、間葉系幹細胞が肝細胞に分化誘導される際にWnt/β-cateninシグナルは抑制されていることが示唆された。TCFモチーフを3回もつpTCF4-CMVルシフェラーゼプラスミドによるレポーターアッセイによりWnt/β-cateninシグナルは抑制されていることを確認した。
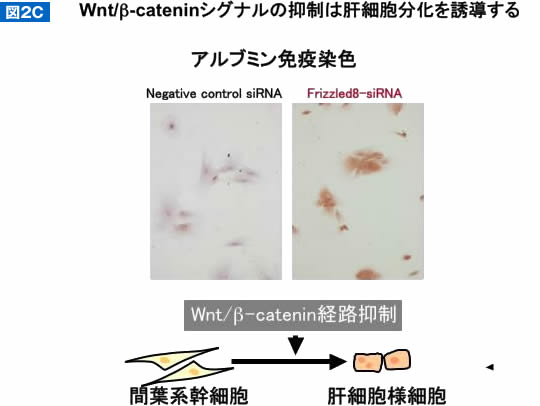
さらに、Wnt/β-cateninシグナルを抑制することを確認したFrizzled8に対するsiRNAによりWnt/β-cateninシグナルを抑制すると、3週間後には肝細胞への分化が促進されることが示された。これらの結果は、Wnt/β-cateninシグナルの抑制がヒト間葉系幹細胞から肝細胞への分化誘導に重要であることを示している(図2C)。
図2. ヒト臍帯血由来間葉系幹細胞の肝細胞への分化誘導
(A)分化誘導条件
(B)分化誘導時のWnt/β-cateninシグナル遺伝子発現変動
(C)Wnt/β-cateninシグナル抑制によるヒト臍帯血由来間葉系幹細胞の肝細胞への分化誘導
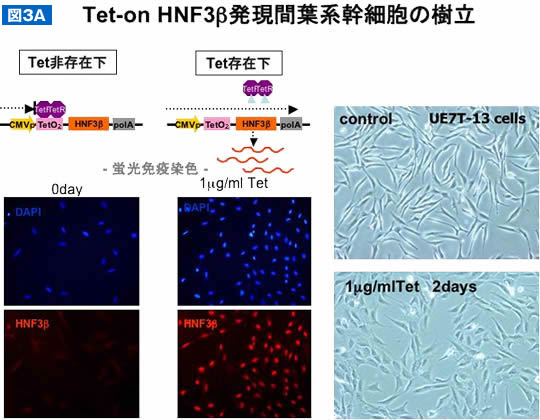
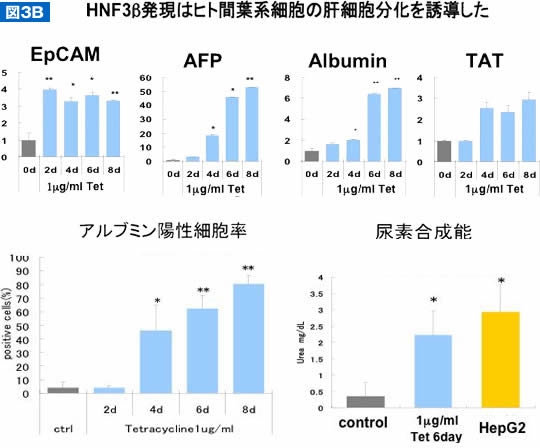
さらに、胎生8~9日に肝原基で発現し肝初期発生に重要であるHNF3βをテトラサイクリン誘導性に発現するEU7T-13 細胞を樹立し、肝細胞への分化を検討した11). これらの細胞は1μg/mlテトラサイクリンでHNF3β発現が強く誘導され、投与2日後には細胞形態が線維芽細胞様からやや幅の広い細胞に形態が変化した(図3A)。肝細胞への分化能を検討すると、テトラサイクリン投与2日後より肝細胞初期マーカーであるEpCAMが発現増加し、4日後にはAFPが増加し、中後期マーカーであるアルブミンは6日後、TATは4日後から発現増加した。免疫細胞染色では、アルブミン陽性細胞は8日後に80%に達した。PAS陽性細胞も同様に増加し、尿素合成能は6日後にはHepG2細胞に近い値を示した(図3B)。これは6~8日という短い期間にある程度の肝機能をもつ細胞に分化したことを示している。
発生初期において肝原基は心臓中胚葉からFGFシグナルを受けることが知られるが、これらの肝細胞分化過程ではFGF受容体発現量が増加しており、FGFへの応答性が亢進していることが示唆された。テトラサイクリンと同時にFGF2を添加すると肝細胞への分化は促進され、この分化誘導系は肝臓の初期発生をミミックした系であると言える。
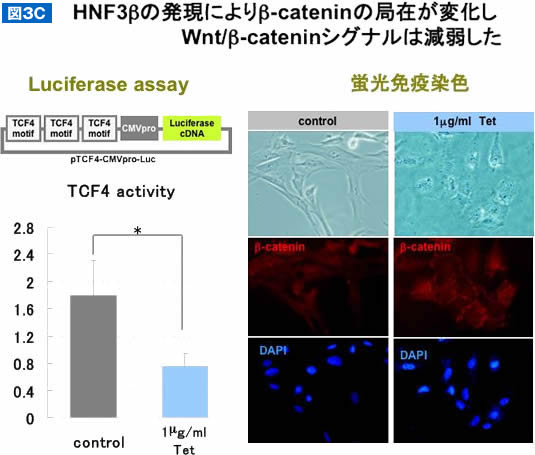
さらに興味深いことには, 本実験系も肝細胞分化誘導過程でWnt/β-cateninシグナルが抑制されていることをレポーターアッセイで確認した(図3C)。β-catenin量、リン酸化β-catenin量、GSK3β量は不変であった。しかし、β-cateninが細胞質や核から細胞膜周辺に移動していることを認め、β-cateninの細胞内局在の変化がWnt/β-cateninシグナルの低下に繋がったと推定される。
図3.ヒト臍帯血由来間葉系幹細胞へのHNF3β発現誘導システム
(A)HNF3β発現誘導系の樹立
(B)HNF3β発現誘導によるヒト臍帯血由来間葉系幹細胞から肝細胞への分化誘導
(C)HNF3β発現誘導によるWnt/β-cateninシグナル抑制
おわりに
ヒト間葉系幹細胞を肝臓特異的な機能をもつ機能性肝細胞へ分化誘導することは可能である。つまり、肝再生医療の実現化に向けて、間葉系幹細胞は肝再生医療の細胞ソースとして有用であり、さらに分化誘導時にWnt/β-cateninシグナルの抑制が有効であることを明らかにした。これらは肝再生医療の開発をしていく上で重要な知見であり、今後は、より高度の機能をもつ肝細胞創出への研究が必要である。
文献
- Oertel M, Shafritz DA: Stem cells, cell transplantation and liver regeneration. Biochim Biophys Acta 1782:61-74, 2008
- Oh SH, Witek RP, Bae SH, et al.: Bone marrow-derived dehaptic oval cells differentiate into hepatocytes in 2-acetylaminofluorene/partial hepatectomy-induced liver regeneration. Gastroenterology 132:1077-1087,2007
- Takahashi K, Yamanaka S: Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell 126:663-676,2006
- Takahashi K, Tanabe K, Ohnuki M, et al.: Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell 131:861-872,2007
- Lee KD, Kuo TK, Wang-Peng J, et al.: In vitro hepatic differntiation of human mesenchymal stem cells. Hepatology 40:1275-1284,2004
- Lee KD, Kuo TK, Chen KD, et al.: Isolation of multipotent mesenchymal stem cells from umbilical cord blood. Blood 103:1669-1675,2004
- Takeda Y, Mori T, Imabayashi H, et al.: Can the life span of humn marrow stromal cells be prolonged by bmi-1, E6, E7, and/or telomerase without affecting cardiomyogenic differentiation? J Gene Med 8: 833-845,2004
- Mori T, Kiyono T, Imabayashi H, et al.: Combination of hTERT and bmi-1, E6, or E7 induces prolongation of the life span of bone marrow stromal cells from an elderly donor without affecting their neurogenic potential. Mol Cell Biol 25:5183-5195,2005
- Shimomura T, Yoshida Y, Sakabe T, et al.: Hepatic differentiation of human bone-marrow-derived UETT-13 cells: Effectss of cytokines and CCN family gene expression. Hepatol Res 37:1068-1079,2007
- Yoshida Y, Shimomura T, Sakabe T, et al.: A role of Wnt/beta-catenin signals in hepatic fate specification of human umbilical cord blood-derived mesenchymal stem cells. Am J Physiol Gastroenterol Liver Physiol 293:
G1089-1098,2007 - Ishii K, Yoshida Y, Sakabe T, et al.: Hepatic differentiation of human bone marrow-derived mesenchymal stem cells by tetracycline-regulated
hepatocyte nuclear factor 3 beta. Hepatology 48: 597-606,2008










