研究交流
肝細胞培養と小型肝細胞について
三高 俊広
札幌医科大学医学部附属がん研究所分子病理病態学部門 教授
【はじめに】
増殖能の高い肝細胞が存在するということを最初に報告(1)してから、15年以上経つ。成熟肝細胞よりは小さいが増殖する肝細胞という意味で小型肝細胞(small hepatocyte)と名付けたのが現在の研究の始まりと云ってよいのかもしれない。良い機会であるので、小型肝細胞について発見から現在に至るまで、自分がどのように考えこの研究を進めてきたかを書き残しておくことにした。若手の研究者や新たにこの分野の研究を始めた研究者に、これまでの小型肝細胞研究の流れを理解してもらうにも丁度良い機会と思ったからである。ホームページ上に会員同士の研究交流を盛んにする場を設けた意味は、論文にはできないが重要だと思うことや失敗、それぞれの研究者が考えていること、学会などでは話しにくいことを積極的に出すことで、議論が活発になり、新たな発想を生むことにあると思う。また論文になっていないことが必ずしも新規の研究というわけではなく、実験は為されたが結果が思わしくなかった、また説明がつかない結果だったなど、論文にできなかった様々な理由があるかもしれない。そのような経験を共有できれば、「肝細胞」を共通語に集う研究者コミュニティーの結束や個々の研究者の新たな発想の種になるかもしれない。さらに同じ失敗を繰り返すことで時間を無駄にすることが無くなるようになればそれにこしたことはない。
【Nicotinamideとの出会い】
私は、1988年春に米国Wisconsin大学McArdle 癌研究所Henry C. Pitot教授のもとでポスドクとして研究を始めた。Pitot教授から与えられたテーマ(実際は、5つぐらい提示された中から一つ選択したのだが)は、「Serine Dehydratase (SDH)を初代培養肝細胞で維持・誘導できるような培養系をつくる」であった。当時、私の持っていた手技は肝細胞の分離培養と免疫染色くらいで、選択肢も限られていた。SDHは、生化学研究者でもあったPitot博士が酵素化学で染色できることを世界で最初に示した酵素で、思い入れもあったのであろう。後に他の研究者から聞かされたのは、新人のポスドクには必ずといってよいほど与えられていたテーマで、これまで誰も成功していないということだった。初代培養肝細胞は、「培養後早期に分化機能を消失する」というのが当時の常識で、今なお培養肝細胞を使った論文のIntroductionにはこれに相当する表現を使う。何をもって肝細胞の分化機能というかは立場により異なるが、成熟肝細胞が持つほとんどの機能を培養肝細胞で発現させ、一定期間(通常は1週間以上)維持させることは可能である。Introductionにこのような表現を入れるためには一定の条件下でという但し書きが本来なら必要なはずである。肝臓の持つ分化機能の中でもSDHの発現は最も高度なものの一つである。12月末までの8ヶ月間この研究を行い、当時知られていた分化誘導方法は全て試した。当時非常に高価で購入できなかったEngelbreth-Holm-Swarm sarcoma-derived matrix (EHS gel; Matrigel®) は、腫瘍をマウスに植え継ぎ、そこから粗精製して実験に使った。培養5日目でdexamethasoneとglucagonによってSDH酵素活性を誘導することが目標だった。得られた結果は全てnegativeで、クリスマスの時にPitot博士と相談しこの研究は一旦諦めた。このSDHをホルモンで誘導し維持できる実験系ができたのは、その7年後だった(2)。Pitot博士からは好きなことをやっても良いと言われ、肝細胞を増殖させる実験系を確立し、in vitroでの肝発癌研究を目標にした。最初の3ヶ月は過去の論文を狩猟し、その再現実験を行った。結果は、“初代培養ラット肝細胞はS期には入るがM期まで進む細胞はほとんどいない”ということを確認したにすぎなかった。つまり、肝細胞の数を増やし続けることに誰も成功していない、ということだった。当時手に入るEGF, HGFなどの増殖因子を使っても、またprolineやethanolamineなどの栄養素などを添加した培養液を使っても、さらに細胞増殖すると報告があった特殊な培養液(Chee’s medium)を自分で調製して実験を行っても、細胞分裂する細胞はほとんど見られなかった。4ヶ月ほど試行錯誤が続いていたある日、ボスから一つの論文が渡された。JBCに掲載されたInoue C.が筆頭著者で東北大学の岡本宏先生の教室と徳島大学の市原明先生の教室との共同研究結果である(3)。nicotinamideとEGFを使うと10%FBS添加の通常培養液でも初代培養ラット肝細胞は増殖し、且つ長期間肝分化機能も維持されるというのである。実験結果は画期的で、核数が培養5日間で2.7倍に増えて、1ヶ月後でも約70%の細胞が生存していた。なおかつ高度な肝分化機能の一つであるTryptophan 2,3-dioxygenase (TO)が12日目でも誘導されるというものだった。私が追試を行っても同様の結果が得られた。細胞数を実際に数えても明らかに2倍以上増殖する。そこでnicotinamideとEGFを使い、無血清で肝細胞を増殖させる実験系をつくることに目標を定めた。追実験では論文としてまとめることができないということもあるが、血清中の未知の成分の影響を除くこと、また血清を添加すると肝細胞の純度を99%以上にしても、培養経過と共に非実質細胞(Nonparenchymal cell, NPC)、特に線維芽細胞(Fibroblast)の増殖は避けられないという経験則があるのでそれを克服したかった。
【Nicotinamideと無血清培養】
実験結果は、1991年のHepatologyに掲載された(4)。要点は、無血清培養によく用いられているDMEM/F12培養液に10 mM nicotinamideと10 ng/ml EGFを加えると初代培養ラット肝細胞は増殖するということである。培養5日目に細胞総数では約1.8倍に増えたが、その内訳をみると1核の細胞数は2.3倍に増えている一方、2核の肝細胞は減少した。多くの肝細胞は同期してDNA合成に入り、DNA合成の最初のピークは60時間目にみられた。nicotinamideを含まない通常の培養液の場合の48時間目と比べると遅れる。以後84時間目、104時間目とDNA合成のピークは同調し、ほぼ24時間間隔であった。この結果は、1核の肝細胞が少なくても3回分裂している可能性を示唆していた。3H-thymidineと2-bromo-5-deoxyuridine (BrdU)を交互に投与した2重染色法とSister choromatid exchangesを調べる手法を応用して、培養4日目までに10~20%の肝細胞が3回分裂し、4回目に入る細胞もいることを証明した。
この実験系では、肝細胞が増殖するためにnicotinamideは必須であり、その濃度は5 mM以上必要で、20 mMを超えるとtoxicityがあり、最適濃度は10 mMであった。増殖因子はTGF-αやHGFでも同様の効果を認めた。20 ng/ml以上にしても10 ng/mlと差がなかったので以後、10 ng/mlを我々の実験の標準濃度としている。無血清で長期培養を行う時、7日~10日を過ぎると細胞の所謂“活き”が悪くなる。血清中に含まれる微量元素等が培養細胞に重要であることは以前からよく知られていて、中でも培養液中のseleniumと鉄の含量が影響するのであろう。市販されているITS (insulin, transferrin, selenium)は、一週間以上の無血清培養を行う場合には添加が必要である。これらの添加により初代培養肝細胞は分化機能を維持しながら1ヶ月以上培養可能である。nicotinamideの“培養”肝細胞の増殖に対する作用機序は、Inoueら(3)が指摘しているように、1)vitaminとして細胞内のNAD供与体であること、2)強力なpoly(ADP-ribose) polymerase (PARP) inhibitor作用を持つこと、によると考えられる。以前から肝細胞のPARP活性は、培養皿に接着後すぐに上がることは知られていた(5)。PARPによりタンパク質、特に核内タンパク質、のADPリボシル化がおこり、転写やクロマチンの制御機構にepigeneticな変化が起こる。その結果、初代培養肝細胞では増殖や分化に関係する遺伝子が不活性化されるため、細胞分裂が起こりにくく、分化機能の急速な低下を引き起こすと考えられる。nicotinamideの持つ強力なPARP阻害活性がタンパク質のADPリボシル化を抑制し、またNADの細胞内濃度を保つことで肝細胞の増殖能力及び多くの肝分化機能が維持されると推測される。PARP 阻害剤である3-aminobenzamide (3-AB)は、nicotinamideより強い増殖促進作用を持っているが、分化機能の維持は悪い、また弱いPARP 阻害活性を持つ3-acetylpyridine (3-AP)は、増殖促進作用は弱いが分化能の維持はnicotinamideより良かった(6,7)。一方、vitamin活性を持つがPARP阻害活性は持たないnicotinic acid を投与しても、nicotinamideほど増殖能力や分化能の維持効果はなかった。これらの結果は、肝細胞が持つ増殖・分化能力を培養下で維持するためには、エネルギー源の供給とヒストンなど遺伝子転写に関係するタンパク質などのepigeneticな修飾を抑えることが重要であることを示唆している。残念ながらその転写制御などについての解析は全くできていない。
〖閑話〗
Time-lapse撮影装置付きの顕微鏡で小型肝細胞の分裂を撮影しているときに興味深い現象を観察した。一つは、1核の肝細胞が細胞分裂をし、2つの細胞に分かれる直前に細胞質が再び融合し、2核の肝細胞になる像(Movie 1)、もう一つは、(多分)1核の肝細胞が4極分裂をし、4核の細胞になる像(Movie 2)である。2つ目については分裂の途中までであるので確かなことは云えないが、8Nの核が2Nずつ4つに均等に分裂しているだろう。nicotinamideを使わないこれまでの初代培養肝細胞では多核の巨細胞が出現するがそれらは細胞融合の結果であるので明らかにそれとは異なる。2核の肝細胞が出現する機序を解明する手がかりであるとは思うがどのように解析したらよいかわからない。
【肝細胞増殖と培地】
エネルギー源の供給という意味では、米国で行ったもう一つの研究が参考になる。当時、初代培養ラット肝細胞の分化機能の長期維持という観点からいうとLeibovitz L-15培養液を使った実験が最も良い結果を出していた(8, 9)。この培養液は、ウイルス培養用に開発された培養液で大気中でも細胞培養できるように個々の必須アミノ酸濃度を限界近くまで上げ、CO2-incubatorが無くてもバッファー効果を持つように調整されていて、NaHCO3を添加する必要がない。しかし、この条件下では増殖因子を加えても増殖させることはできなかった。ところが、このL-15培養液にNaHCO3とEGFを加え、CO2-incubatorで培養すると肝細胞は劇的に増殖をし始めた(10)。当時既にL-prolineがDNA合成に必須であることは知られていた(11、12)が、L-15培養液には含まれていなかったのでL-prolineも加えた。増殖能はnicotinamideと同程度で有りながら、分化能の維持はnicotinamideを用いた場合よりはるかに良かった。HCO3-は肝細胞の増殖には必要であり、培養液中の濃度によってDNA合成に影響を与えることもわかった(13)。市販の培養液のNaHCO3濃度は、それぞれの培養液が開発された時に使われた細胞や目的によって決められたもので肝細胞の増殖に合わせて決められたものではなく、例えばDMEMは約44 mMに調整されている(カタログ上)が、ラット肝細胞の増殖という点でいうと25 mMが最適である。我々の教室では25 mMに調整し使っている。L-15培養液が増殖能の維持に良い理由の一つに、必須アミノ酸濃度の高いことがある。DMEM/F12培養液に市販の必須アミノ酸濃縮液(DMEM/F12培養液の組成)を加えてL-15培養液におけるその濃度に近づけていくと肝細胞の増殖能が高まっていく(10)。また、L-15培養液を用いてラット肝細胞を増殖させるときれいにcontact inhibitionがかかる。Labeling indexで増殖する肝細胞の割合を見ていくと、DMEMなど通常の培養液では細胞密度に依存してなだらかに減少するのだが、L-15培養液を使うと肝細胞数が800細胞/mm2に近づくとDNA合成がほぼ止まるのである(10)。L-15培養液のアミノ酸濃度は、肝細胞の持つ増殖能力を発揮させるのに十分な濃度なのかもしれない。アミノ酸が肝細胞の増殖に必須であることはよく知られている。特に非必須アミノ酸を培養液から除くとcyclinD1発現が抑制され、肝細胞はS期に入らないことがわかっている(14)。nicotinamideをL-15培養液に加えると増殖にも分化能の維持にもよいのではないか、とよく聞かれる。しかしながら、両方を用いると細胞毒性が出て肝細胞は死ぬ。今のところその機序はわからない。
コラゲナーゼで灌流し、Percollを用いて純化した肝細胞を得ようとしても100%にすることはできない(15)。99%以上肝細胞にすることはできるが、わずかなNPCの混入(contamination)は避けられない。私は、米国から帰国後5年間ほど極東製薬に特別注文した培養液を使っていた。DMEMを基本にL-prolineを30 mg/lに増量し、glucoseの代わりにgalactose (2 g/l)、L-arginineの代わりにL-ornithine (100 mg/l) を用い、鉄、銅、マグネシウム、ニッケル、セレニウムなどの微量元素を加えて無血清培養をおこなった(1)。Fibroblastはgalactoseやornithineを代謝できないこと、無血清では増殖できないことを踏まえて使用したのだが、肝細胞は活きが良いほどglucoseを放出するし、多くの血清タンパク質を分泌するので培養初期には確かにFibroblastの増殖を抑えることはできたが、長期間培養を続けるとFibroblastはやはり増生してくる。肝細胞の増殖を抑制せずにFibroblastの増生が抑制できるのは1%DMSOを使った場合のみだった。効果があまりないことと注文を受けてもらえなくなったこともあり、市販のDMEMに変えた。
コンタミする主なNPCは、肝上皮様細胞(Liver epithelial cell, LEC)およびFibroblastである。これらの細胞の増殖は、dimethylsulfoxide (DMSO)を添加することで抑制できる(殺すわけではない)。肝細胞をsemi-confluentの濃度で播種し、L-15培養液に増殖因子を加えて培養し、4日目から2%DMSOを加えると6日目で細胞数は約2倍になり、ほぼconfluentな状態になる。高度な肝分化機能を維持したまま約2ヶ月間、細胞数をあまり減らさずに培養することができる(16)。2%DMSOを培養液に添加すると初代培養肝細胞の高分化機能を無血清でも長期間維持できることは、Isomらにより既に報告されていた(17)。この培養条件ではNPCの増殖はほとんど認められない。しかしながら、vimentinをマーカーにしてLECやFibroblastの動態を調べると、肝細胞が死んでできる隙間にvimentin陽性細胞が徐々に増えてくる一方で、肝細胞の存在する部分ではほとんど増えないということであり、NPCが一見増えていないように見えるだけであった。1%以上のDMSO存在下ではNPCの増殖を抑制するが、肝細胞が存在しないとその効果は減少するので、肝細胞の分泌するある種の因子がNPCの増殖を抑制しているのだろう。また1%では肝細胞の増殖は抑制しないが、2%で肝細胞の増殖はほぼ完全に抑制される一方、分化機能は亢進する。この実験系を用いるとGap junctionタンパク質のCx32, Cx26を発現誘導し、長期間維持することができる(18,19)。加えて米国で上手く誘導できなかったSDHも発現させることができた(2)。これらの高度な肝分化機能は、HNF1, 3, 4及びC/EBPα, βの発現増加と相関しているのは云うまでもない(20)。DMSOをタイミングよく使うことにより増殖を抑制し、静止期に導入した肝細胞を再び増殖させることも可能である。L-15+EGF+2%DMSOからDMEM+EGF+nicotinamideへと培養液を交換することにより、静止していた肝細胞は再び増殖を始める(21)。これまで述べた初代培養肝細胞については英文総説を書いているので参照してほしい(22)。
【小型肝細胞】
Nicotinamideと増殖因子を加えて肝細胞を培養すると、3日目に多数の細胞分裂像を見ることができた。そのまま培養を続けると大型の肝細胞の中に明らかに小さな細胞集団が出現することに気がついた。核の形や性状は肝細胞と同様で細胞質も充実していることから形態学的には肝細胞そのものであるが、明らかに小さい。周りの細胞の1/2~1/3の大きさで培養経過と共に更に小さくなる。BrdUや3H-thymidineを用いてラベリングすると、1核の細胞が固まって増殖していた(図1)。
albuminやcytokeratin (CK)8/18などの肝細胞マーカー抗体を用いて免疫染色しても陽性であり、超微形態学的(図2)にも肝細胞の特徴を有していたことから、これらの細胞は肝細胞への分化が方向付けられた前駆細胞の一種であろうと考え、「Small hepatocyte(小型肝細胞)」と名付けて報告した(1、23)。
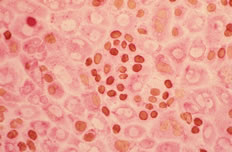 図1.小型肝細胞コロニー。40 mM BrdUを培養後96時間目から48時間投与し、エタノールで固定後、抗BrdU抗体と抗albumin抗体を用いて2重染色を行った。 |
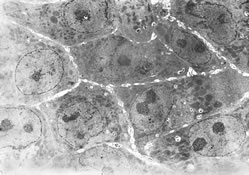 図2.小型肝細胞の透過電子顕微鏡写真。培養5日目。 |
小型肝細胞は、EGF/HGF/TGF-αいずれかの増殖因子がないと出現しないこと、これらの増殖因子間に出現率に差がないこと、acidic/basic FGFは誘導能を有しているが出現数は少ないこと、所謂co-mitogenとして知られていたnoradrenalinやIGF-I, TNFαなどでは誘導されないことがわかった(24)。さらに小型肝細胞コロニーの出現はラット週齢が増すほど減少する(25)。3週未満の仔ラットから分離した肝細胞は旺盛な増殖能を保持しているため、ほぼ全ての細胞がラベルされコロニーとして認識できないが、離乳期(満3週前後)を過ぎたラットから分離した肝細胞を使うとコロニーと認識できるようになる。言い換えれば増殖能の低下した(やや大型の)肝細胞が出現するのが4週目以降であるということである。増殖している新生仔肝細胞は、大きさが小型肝細胞と同じぐらいなので小型肝細胞のoriginと考えたが、DNAchipを用いて成熟化誘導した小型肝細胞と2週令の肝細胞の遺伝子発現パターンとを比較すると、in vivo/in vitroの違いを考慮しても明らかに異なり、新生仔肝細胞は成熟肝細胞とほぼ同じ遺伝子発現パターンを示した(未発表データ)。4週令の肝細胞の約6%が小型肝細胞コロニー形成能を有し、6週令で約2.5%と激減し、8週令以降の成熟ラットではほぼ1.5~2%で一定になる。80週令を超えたラットではコロニー形成能はその1/3にまで低下した(25)。立野らも、同様に小型肝細胞コロニー数が年齢と共に減少することを報告している(26)。最近我々は、ヒト小型肝細胞の分離と培養に成功した(27)。ウイルス性肝炎を背景に持っていない患者の肝部分切除術時に得られた小肝組織から分離した細胞を用いたのだが、そのような手術を受ける患者の多くは60歳以上である。これまでに20例以上実験を行ったがほぼ全例で小型肝細胞コロニーの形成を認めた。若い(40歳以下)ヒトからの肝組織を得るのは難しく、年齢によるコロニー形成能の違いを確かめることはできなかったが、老齢になっても増殖能の高い肝細胞が存在するのはヒトにおいても間違いない。今後の課題である。
「小型肝細胞のoriginの細胞はどの細胞なのか?」は、今なおよく質問される。私は正常成熟ラットにおいては「肝細胞がoriginである」と答えている。「形態的には区別がつかないが一見成熟肝細胞に見える細胞の中に小型肝細胞として能力を隠し持つ細胞が存在している」と考えているのである。その理由は、(1)NPCを1%以下しか含まない肝細胞を培養皿上に播種し、小型肝細胞の出現とコロニー形成の様子を毎日観察し、写真に撮って確認しても肝細胞以外の形態をとる細胞はコロニー周囲には全く見られないこと(図1)、(2)50xg 1分間の低速遠心後の上清に含まれるNPCを主に含む画分を培養皿に播種し、コロニー形成の様子を追跡しても肝細胞の形態を示す細胞以外からコロニー形成が見られないこと(図3)、
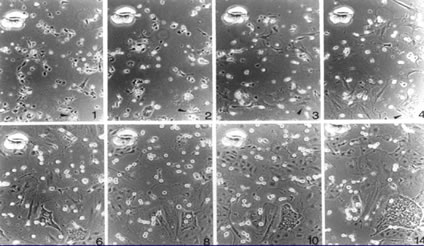
図3.小型肝細胞コロニー形成。培養皿の同一箇所を位相差顕微鏡で観察し、毎日撮影した。数字は培養後日数。矢頭は小型肝細胞を示す。
(3)無アルブミンラット肝細胞と正常肝細胞を混合培養するとアルブミン陽性コロニーと陰性コロニーがその混合割合に応じて培養早期から見られること(図4A)、(4)ヒアルロン酸コートdish上に接着するのは肝細胞と類洞内皮細胞であったが、コロニーを形成するのは肝細胞のみであった(28)(図4B)。
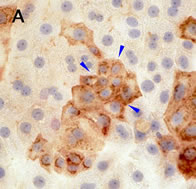
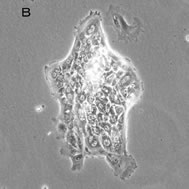
図4. A)無アルブミンラット肝細胞中に10%SDラット肝細胞を加えて培養し、5日目に固定した後、抗albumin抗体で免疫染色した。albumin陽性小型肝細胞コロニーを認める。
B)ヒアルロン酸コートdish上で無血清培養したラット小型肝細胞。培養10日目。
1993年頃、吉里勝利教授から肝細胞を増やして人工肝臓を作る研究を始めるので手伝ってほしいと話があった。吉里再生機構プロジェクト(ERATO)の研究推進委員として2年ほど協力した。研究に対する考え方の違いから別々に研究することになったが、立野らの初期の研究(26,29)にはささやかな協力ができたと思っている。私が関係していた研究以外でも、マウス肝細胞培養に10 mM nicotinamideを添加し増殖させた細胞を用いた報告がなされているが(30)、“nicotinamideを培養液に加えると肝細胞は増殖する”ことが浸透してきたのは、肝再生研究の第一人者であるMichalopoulosらが、肝細胞の培養にnicotinamideを用いてからである(31)。これ以降、肝細胞を増殖させる研究でのnicotinamide添加は一般化されたと思われる。
【小型肝細胞の成熟化と類肝組織形成】
コラゲナーゼで肝臓を灌流して得られた細胞分散液を低速遠心(50xg 1~2分間)すると、多くの成熟肝細胞は比重が重いため沈殿する。しかしながら、全ての肝細胞が沈殿するわけではなく、比重の比較的軽い肝細胞は上清画分に残っている。成熟肝細胞と明らかに大きさが異なる小型肝細胞は、酵素作用により完全にsingleになると沈殿せずに上清画分に残る。上記したように、沈殿した肝細胞を播種しても小型肝細胞コロニーが出現するのは、大型の肝細胞と共沈した小型肝細胞が多数存在することを意味し、小型肝細胞が成熟肝細胞と共に小葉内に存在していることの証明にもなっている。上清画分の細胞には、小型肝細胞の他に、肝NPCと云われる星(伊東)細胞、Kupffer細胞、類洞内皮細胞、LEC、血球などが含まれる。さらに低速遠心(50xg)を5分間行うと血球以外の細胞の多くは沈殿する。1分間と5分間の遠心を何度か行うことにより得られた細胞を培養皿に播き、nicotinamideを含む培養液で培養する(32)。播種した細胞の割合は、CK8陽性細胞(肝細胞)が約35%、SE1陽性細胞(類洞内皮細胞)が約20%、vimentin陽性細胞(LEC、Fibroblast)が約18%、ED1&2陽性細胞(Kupffer細胞)が8%、desmin陽性細胞(星細胞)が約10%であった(33)。胆管上皮細胞(biliary epithelial cell, BEC)マーカーであるCK19に陽性な細胞は0.3%と、この方法を用いるとBECはほとんど分離されてこないことがわかる。これらの細胞を培養すると上皮の形態を示す細胞が分裂を開始する。早い細胞で播種後2日目から、多くは3日目から分裂を開始し、7日目には約20個、10日目には約30個の細胞からなるコロニーを形成する(図3)。コロニーの大きさは様々で50細胞以上からなるコロニーも存在する。立野らは10日目で100個以上の細胞からなるコロニーを観察している(26)。ヒト小型肝細胞の中にも10日目で150個以上に増殖するコロニーが存在している(27)。私は、小型肝細胞コロニーを定義づける際に「培養6日目に小型で8個以上BrdU(48時間ラベル)陽性細胞がまとまって存在している」とした(図1)(1)。しかしながら、これらの事実は小型肝細胞が増殖能に関して一様ではないことを示し、非常に増殖能の高い細胞も存在することを意味している。コロニーの中の一部の細胞は、培養10日を過ぎると大型化してくる。2核の細胞も出現する。培養経過と共に構成する全ての細胞が大型化するコロニーが存在する一方、多くのコロニーには大型細胞と小型細胞が混在する(図5)。
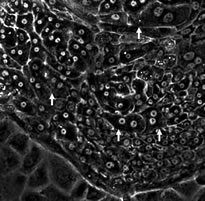
図5.小型肝細胞コロニーの位相差顕微鏡写真。矢印は、大型化した小型肝細胞を示す。
小型細胞、大型細胞がそれぞれまとまって存在し、小型細胞が主に増殖しているようである。印象ではあるが、特に増殖能の高い細胞からなるコロニーは全体が一様な、より小さな細胞からなり、培養経過に伴い通常現れる大型の細胞は存在しない。小型肝細胞の中にも自己保持能を有する細胞が存在しているだろうと推測しているが、証明はしていない。
上記のような小型肝細胞とNPCからなる細胞をFBSやnicotinamide、増殖因子(EGF, HGF, TGF-α)などを加えた培養液で培養すると、小型肝細胞が最初に増殖しコロニーを作る一方、星細胞とLECもゆっくりと増殖してくる(32)。類洞内皮細胞は1週間ほどでほとんどいなくなるが、Kupffer細胞は生き残り、コロニーが大きくなるにつれ、コロニー上でゆっくり増殖する。増殖している星細胞やLECと接触し、小型肝細胞コロニーを取り囲むようになる(図6)。2週間を過ぎるとそのようなコロニーをよく認めるが、NPCに近在する細胞から大型化が見られ、細胞の厚みが増し立体感が出はじめ、一部の細胞がコロニーの上に盛り上がり、培養経過と共にコロニーの上に広がっていく(図7)。
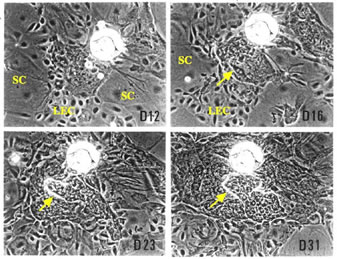
図6. 小型肝細胞コロニーの培養経過に伴う形態変化。数字は培養日数。矢印は盛り上がってくる細胞を示す。SC, stellate cells; LEC, liver epithelial
cells.
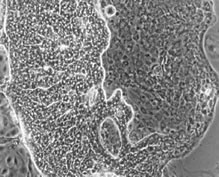 図7. 小型肝細胞コロニーの位相差顕微鏡像。培養35日目。NPCが接しているコロニー側から細胞が盛り上がり、コロニー上で索状構造を形成していることがわかる。 |
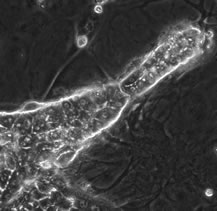 図8. コロニーの外側に索状構造が伸長していく。細胞間に白く筋状に見えるのは毛細胆管様構造。 |
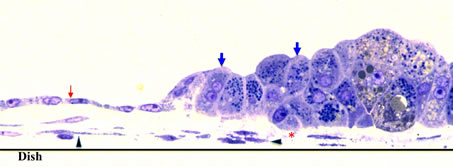
図9. 小型肝細胞コロニーの盛り上がった部分の縦断面(培養75日目)。透過電子顕微鏡写真を撮るために作ったsemi-thin sectionをトルイジン染色した。小型肝細胞(細い矢印)が急に大型の細胞(太い矢印)に変化していることがわかる。コロニーの下にNPC(矢頭)が潜り込み、2~3層に重なった大型細胞(太い矢印)との間に細胞外基質(asterisk)が蓄積している。大型細胞は、mitochondria, rER, glycogen granules, peroxisomeに富んでおり、細胞間には毛細胆管様構造、gap junctionを持ち超微形態学的にも典型的成熟肝細胞を示す。
その後盛り上がった細胞は2~3細胞の厚さからなる索状構造をとり、コロニー外に伸びていく(図8)。盛り上がった細胞の部分を培養皿に対して垂直に切り、その断面を見たのが図9である。大型化した小型肝細胞が多層化し三次元構造を呈している部分では、NPCが大型細胞の下に細胞外基質を挟んで存在している。2ないし3肝細胞が重層しているが、それ以上の多層化は見られない。また肝細胞とNPCの間には細胞外基質の薄い層が見られる。中間系フィラメントに対する抗体を用いて細胞を同定すると、コロニーの下に存在する細胞はdesmin陽性(星細胞)とvimentin陽性細胞(LEC)であった(図10)。
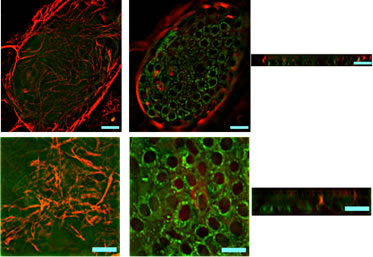
図10. 小型肝細胞コロニーの蛍光免疫染色写真。上図は、albumin (green)とvimentin (red)、下図はalbumin (green)とdesmin (red)の二重染色を示す。CellScanを用いた3次元再構成画像。dish直上plane (上左)、約8μm上のplane (上中)、断層面(dish面は上)(上右)、dish直上plane (下左)、約12μm上のplane (下中)、断層面(dish面は上)(下右)。 Bar, 20μm.
コロニーの下に存在する細胞外基質は、laminin,type IV & III collagen,fibronectinが主であり、培養経過と共に蓄積する(33)。これらの細胞外基質は基底膜の構成成分であり、基底膜様構造を構築しているものと思われる。また、type I collagenの蓄積は少なかった。smooth muscle actin (SMA)陽性細胞はほとんど認められないことを考え合わせると、活性化していない星細胞とLECがコロニーの下に潜り込み、細胞外基質を分泌していると考えられる。laminin,type III & IV collagen,fibronectinなどの基底膜成分の蓄積と共に小型肝細胞は、成熟化・組織化していくように見えることから、基底膜成分が成熟化・組織化を誘導するか検討した。活発に増殖している小型肝細胞をコロニーごと剥離し、コロニー密度を高めて新しいdishに蒔き直し、増殖している小型肝細胞が多数存在する状態を作った(34)。そこにMatrigel®を加えた。コントロールとしてtype IV collagen, laminin, fibronectinを単独またはそれらのcombinationで添加したが、コロニーの形態変化は起こらなかった(34)。Matrigel®に被覆された小型肝細胞は急速にその形態を変化させた(図11)。
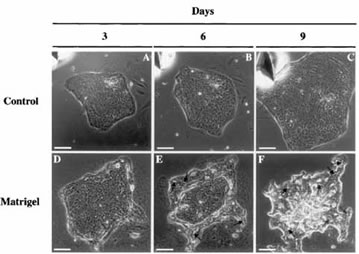
図11. Matrigel®投与後の小型肝細胞コロニーの形態変化。矢印は毛細胆管様構造を示す。Bar, 50 μm。
数日のうちに細胞は大型化し、細胞間には毛細胆管様構造が形成され、コロニー全体が盛り上がった。この様なコロニーの断面像を見ると Matrigel®で覆われた部分は盛り上がり、大型化した肝細胞が重層している。微細構造的にも、それら大型の細胞はmitochondria, rough endoplasmic reticulum, peroxisomeなどの細胞内小器官に富み、細胞間には毛細胆管を形成していることから成熟肝細胞といえる。このような組織化は初代培養肝細胞をNPCと共培養しても、成熟肝細胞をMatrigel®で被覆しても起こらない。分化機能を維持することができても3次元化した類肝組織を形成することはないのである(spehroid形成は見られる)。また、小型肝細胞をMatrigel®の上で培養すると増殖しない。成熟化するためには、小型肝細胞はある程度増殖した後NPCとの相互作用が必要であり、お互いに細胞外基質を分泌することで基底膜様な構造物を再構築する過程が重要であることを示唆している。laminin単独では、成熟化を促進するが3次元化は誘導できなかった。Matrigel®という細胞外基質の混合物(基底膜を構成する細胞外基質の3次元構造が微細なレベルで維持されているという意味)に小型肝細胞が接触するときにのみ、3次元化した類肝組織の構築が起こることを意味している。
類肝組織の肝細胞機能
3次元構造を構築している肝細胞間には毛細胆管様構造が形成される。生体内の毛細胆管と全く同じものなのか、それとも似て非なるものか確かめた。毛細胆管であれば毛細胆管膜面(Bile canalicular domain, Apical domain)に限局して存在しているタンパク質が発現しているはずである。Multidrug resistance related protein 2 (MRP2)、EctoATPase、5’-nucleotidase (5NT 和田郁夫現福島医大教授より供与)など毛細胆管膜面に限局して発現することが知られていて入手可能な抗体を用いて染色した(図12)。
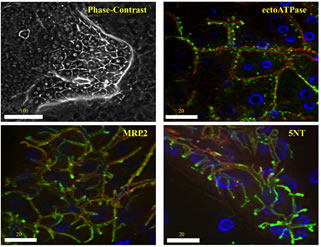
図12. 小型肝細胞コロニーに形成された毛細胆管様構造に発現するタンパク質の免疫三重染色。毛細胆管膜タンパク質ectoATPase, MRP2, 5NT は緑色、Actinは赤色、核はDAPIで青色に染色した。上左図は、典型的なコロニーの位相差顕微鏡写真。単位は、μm.
確かに毛細胆管膜に限局して染まり、なおかつその部位にはactinも重積していた(35)。ごらに機能についても検討した。細胞内にesteraseがあると分解され、その代謝産物が蛍光物質であるfluoresceinになり毛細胆管に分泌されるfluorescein diacetate (FD)を培養液に加えた(図13)。蛍光顕微鏡で観察すると、図14で示すように増殖旺盛な小型肝細胞はFDを細胞内に取り込むがesteraseを持たないためか、または発現しているMRP3により細胞外に即座に排出されるために細胞に蛍光が見られない(36)。
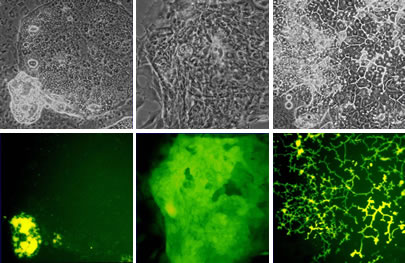
図13. 小型肝細胞の分化段階によるFDの代謝と排泄。上段は位相差顕微鏡写真、下段は蛍光写真。左から、増殖している小型肝細胞(一部にcyst形成が見られ、fluoresceinが蓄積している)、大型化し始めた細胞、盛り上がり3次元構造をとる細胞の典型像を示す。
ところが大型化した細胞を持つコロニーでは、毛細胆管に排泄されるような像は見られないが、細胞内にfluoresceinが見られ、時間とともにMRP3により細胞外に排出されるために薄くなってゆく。一方、3次元構造を取り細胞間に毛細胆管様構造が認められる所では、代謝されたfluoresceinにより線香花火のように見える。毛細胆管がコロニー上に網の目の様に発達していることがわかる(35)。蓄積した蛍光物質は培養液を交換しても減光することはなく長時間維持されていた。またbilirubinを培養液中に加えても黄色いbilirubin色素が毛細胆管内に蓄積していくのを観察することができる(図14)。
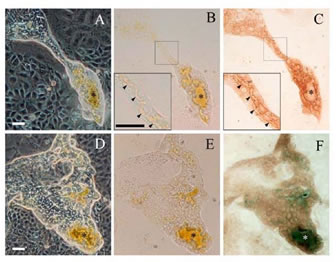
図14. bilirubinが排泄された毛細胆管様構造。位相差顕微鏡写真(A,D)。対応する光学顕微鏡像(B,E)。蓄積したビリルビンが黄色に見える。抗ZO1抗体を用いた免疫染色像(C)。毛細胆管様構造はタイト結合タンパク質であるZO1で囲まれている。タイト結合が良く発達していることがわかる。ビリルビン染色像(F).緑色のビリルビンがcyst状構造(asterisk)内と毛細胆管様構造内に蓄積している
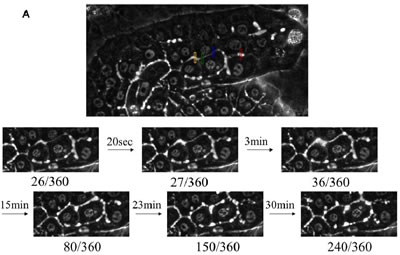
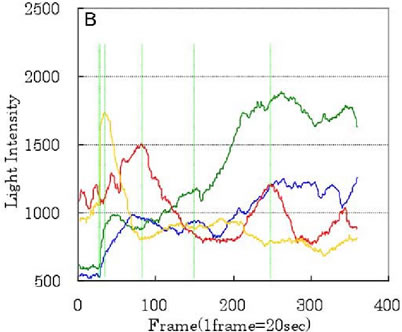
図15. Time-lapse撮影装置を付けた位相差顕微鏡を用いて小型肝細胞コロニーの同一箇所を20秒間隔で2時間360枚連続撮影した。Aは、毛細胆管の拡張及び収縮する様子を示す。Bは、Aの写真上の□で囲った部分(4カ所を色で区別)を2値化し、白色部の面積を毛細胆管の拡張度としてグラフにしたもの。
さらに、Time-lapse装置を付けた顕微鏡でこの毛細胆管を長時間観察することにより収縮・拡張を繰り返し、胆汁を輸送する能力も有することがわかった(図15)(37)。3次元構造を作る細胞には、毛細胆管膜面が形成されるだけではなく、類洞側膜面(sinusoidal domain)や壁側膜面(lateral domain)も形成され、細胞膜は生体内と同様の極性を有するようになる(36、38)。有機アニオントランスポーターの発現を見ると、類洞側膜面にはOrganic anion-transporting protein (Ostp)1,2,4やNa-dependent taurocholate co-transporting peptide (Ntcp)が発現し、毛細胆管面にはMRP2やbile-salt export pump (BSEP)といったtransporterタンパク質が発現するようになる(図16)。正常肝臓では発現していないが胆汁うっ滞時に出現するMRP3は、小型肝細胞にも強く発現しているが、毛細胆管を形成している小型肝細胞ではその発現が消失する。また肝細胞を破壊することなく、これらの毛細胆管内に分泌された物質を回収することも可能である(36)。
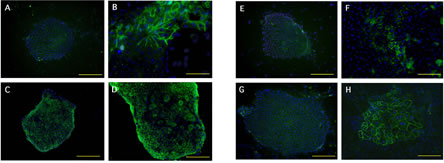
図16. 小型肝細胞におけるトランスポータータンパク質の発現。増殖している小型肝細胞(A, C, E, G)と大型化した細胞(D, F, H)、盛り上がった細胞(B)におけるMRP2 (A, B)、MRP3 (C, D)、Oatp1 (E, F)、Oatp2 (G, H)の発現。増殖している小型肝細胞にはOatp1/2, MRP2は発現していないが、成熟化し大型化した細胞には良く発現するようになる。一方、増殖している小型肝細胞に良く発現しているMRP3は大型化し、盛り上がった細胞では発現消失する。
また、この様に形態的に成熟化した小型肝細胞は、血清蛋白の分泌や糖・アミノ酸代謝、アンモニア代謝や尿素合成、さらにはP450等の薬物代謝酵素の発現など成熟肝細胞とほぼ同様の機能を持っている(33,34,39,40)。しかし、生体内と同等の機能発現までには至っていない。培養皿上での限界なのか、まだ工夫の余地があるのかは定かではないが、現時点では生体内での機能を100%とすると、その60~70%程度の回復と考えている。
【小型肝細胞特異的分子】
小型肝細胞は、肝細胞由来であるとは思いながらも培養するとその特性がいわゆる成熟肝細胞とは異なる。“小型肝細胞に特異的な分子があるのではないか”という思いは当然のことながら研究初期からあり、小型肝細胞に関する一通りの仕事に目途がついた1993年頃から特異的に認識できるモノクローナル抗体作りを始めた。当時、小型肝細胞だけを取り出すことは困難であったため、生後2週ぐらいの乳児期の生肝細胞を抗原にモノクローナル抗体採りを始めた。この時期の肝細胞は小型肝細胞と同様に増殖能が高く、コロニー形成も見られないことから小型肝細胞と同じではないかと思い抗原として使った。GeneChipの結果が手元にある今はわかっていることだが、乳児期の肝細胞は成熟肝細胞とその遺伝子発現はほとんど違わず、小型肝細胞特異的な分子は発現していない。当時20回ほどfusionを行ったが当然の結果として、小型肝細胞コロニーを特異的に染色する抗体は取れなかった。その時の唯一の成果は、毛細胆管膜抗原のectoATPaseに対する特異抗体で、論文(35)の一部のデータに使えたぐらいである。一人で研究していたので時間とお金の面で痛かった。小型肝細胞の組織化の研究に集中するまでの3,4年間はL15培養液を使った肝細胞分化機能維持に関する研究で何とか論文を出し、研究費を得ていたのが実態であった。97年にクローン羊ドリーが現れ、米国Wisconsin大学からヒトES細胞作製の発表があり、世の中が「再生医学」ブームに涌いた。幹細胞研究に注目が集まり日本での肝幹細胞研究をしていた極少数の研究者の一人であった私にも視線が注がれるようになる。小型肝細胞とNPCによる肝組織化の論文(33)が出たのはベストタイミングだった。JSTから大きな研究費をもらい、小型肝細胞特異的分子の研究を始めた。特異的分子を見出し、ヒト小型肝細胞を分離培養し増やすことがこの研究の大きな目標であった。網羅的遺伝子解析、小型肝細胞膜表面タンパク質の網羅的解析、表面抗原に対する特異的抗体の作製などを行い「抗体で細胞を集める方法を開発する」ことを目標に研究を行った。結果的に網羅的遺伝子解析の結果からCD44を同定し(41)、他にテトラスパニンファミリーのD6.1A及びBRI3を見出したが、抗体から特異抗原を見出すことはできなかった。成熟肝細胞と非常に良く似ている細胞であることを改めて認識した。
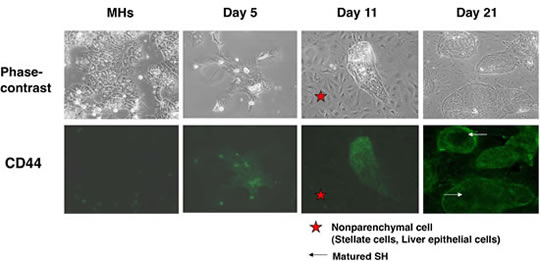 図17. 小型肝細胞の増殖とCD44sタンパク質の発現。上段は位相差顕微鏡写真、下段は対応するCD44sに対する蛍光免疫染色写真。小型肝細胞はコロニーを形成し始めると細胞膜に発現する。培養経過と共に小型肝細胞が成熟化し大型細胞になると発現は消失する(矢印)。
図17. 小型肝細胞の増殖とCD44sタンパク質の発現。上段は位相差顕微鏡写真、下段は対応するCD44sに対する蛍光免疫染色写真。小型肝細胞はコロニーを形成し始めると細胞膜に発現する。培養経過と共に小型肝細胞が成熟化し大型細胞になると発現は消失する(矢印)。
CD44は小型肝細胞が増殖を始め、コロニー形成をしはじめると確かに発現するが、細胞播種時には全く発現していない(図17)。また、成熟化し3次元化した小型肝細胞ではその発現が消失する。CD44が小型肝細胞特異的であるのは間違いないがその発現機序についてはまだわかっていない。CD44は、標準型(s)の他にvariant型(v)がv1~v10まで10種ある。小型肝細胞は、CD44sとCD44v6の2種類を発現するが(41)、それらは同時に発現されるわけではない。CD44v6の発現は、CD44sに数日遅れて認められる。盛んに増殖している小型細胞には発現せず、大型化し始めた小型肝細胞に強く発現するようになる。このCD44v6も3次元構造を形成している細胞では認められないことから、成熟化に関係した分子と考えているが解析は進んでいない。
CD44の主なligandはヒアルロン酸である。小型肝細胞はヒアルロン酸をコートしたdishで選択的に増殖する。type I, type IV collagen, fibronectin, lamininをコートしたdishと比較して実験を行ったが、ヒアルロン酸をコートしたdishでは小型肝細胞の増殖がNPCより速く、コロニーの増生が目立った。ヒアルロン酸レセプターを発現していることが知られている類洞内皮細胞(42)は接着するが、小型肝細胞を増殖させる培養液では増殖はせず、1週間も過ぎるとdishから剥がれていく。ヒアルロン酸コートdishでは、collagenコートdishなどに比べてNPCの増殖が悪いことがわかったので、更に増殖を抑えるために無血清で実験を行った。小型肝細胞がコロニーを作るようになると無血清でも増殖することはわかっていたが(43)、播種時点から無血清にしても小型肝細胞だけが選択的に増殖した。NPCもいくらか残るが10日目の時点で約85%の細胞がCD44陽性でコロニーを形成していた(28)。小型肝細胞の増殖はTGF-αの産生によるautocrineの増殖であると思っていたが、Genechipで遺伝子発現を調べるとfollistatinを特異的に発現していた。培養液中にも分泌されていて中和抗体でその活性を抑制すると、小型肝細胞の増殖が抑制されることから、小型肝細胞の増殖は主にfollistatinの作用によるものと推測している。現在詳しい機序を研究している。
【おわりに】
私のこれまでの肝細胞研究のうち、in vitroの研究の多分間違いが無いだろうと思われることについて書いた。全てではないが、これまでにわかったことを踏まえてできるだけ時系列に沿って分かり易く、失敗も含めて正直に書いたつもりである。最近の研究やin vivoの仕事は、ある程度まとまってからまた書く機会があると思う。15年以上にわたり飽きずに小型肝細胞の研究を行ってこられたのは、この細胞のポテンシャルが極めて高いと信じているからである。ヒトES細胞が樹立され、骨髄由来幹細胞が発見され、またiPS細胞が創出され、それらの研究が急速に進んではいるが、今なお、内胚葉由来の“肝細胞“を誘導することは非常に困難である(44)。小型肝細胞は、肝細胞としての機能を既に持ち、肝組織に類似した類肝組織も作らせることが可能である。加えて成熟肝細胞とは異なり、凍結保存した小型肝細胞は解凍後も初代培養の時と同様に増殖し、成熟化することがわかっている(45,46)。但し、single cellの状態ではなくて、コロニーの状態を維持しながら保存する必要がある。ヒト小型肝細胞をコンスタントに分離することが可能になり、さらに増殖させることができれば細胞バンクも決して夢ではない。肝再生医療に使えるかどうか、見極められるまでは研究を続けたいと思っている。
参考文献
- Mitaka T, Mikami M, Sattler GL, Pitot HC, Mochizuki Y. Small cell colonies appear in the primary culture of adult rat hepatocytes in the presence of nicotinamide and epidermal growth factor. Hepatology, 16, 440-447 (1992).
- Mizuguchi T, Mitaka T, Kojima T, Hirata K, Mochizuki Y. Recovery of mRNA expression of tryptophan 2,3-oxygenase and serine dehydratase in the long-term cultures of primary rat hepatocytes. J Biochem, 120, 511-517 (1996)
- Inoue C, Yamamoto H, Nakamura T, Ichihara A, Okamoto H. Nicotinamide prolongs survival of primary cultured hepatocytes without involving loss of hepatocyte-specific functions. J Biol Chem, 264, 4747-4750 (1989)
- Mitaka T, Sattler CA, Sattler GL, Sargent LM, Pitot HC. Multiple cell cycles occur in rat hepatocytes cultured in the presence of nicotinamide and epidermal growth factor. Hepatology, 13, 21-30 (1991).
- Althaus FR, Lawrence SD, He Y-Z, Sattler GL, Tsukada Y, Pitot HC. Effects of altered [ADP-ribose]n metabolism on expression of fetal functions by adult hepatocytes. Nature 300, 366-368 (1982)
- Sato F, Mitaka T, Mizuguchi T, Mochizuki Y, Hirata K. Effects of nicotinamide-related agents on the growth of primary rat hepatocytes and formation of small hepatocyte colonies. Liver, 19, 481-488 (1999).
- Higaki N, Mitaka T, Sato F, Hirata K, Mochizuki Y. Maintenance of connexin 32 and 26 expression in primary cultured rat hepatocytes treated with 3-acetylpyridine. J Gastroenterol Hepatol, 16, 806-815 (2001)
- Michalopoulos GK, Sattler GL, Pitot HC. Maintenance of microsomal cytochromoes b5 and p-450 in primary cultures of parenchymal liver cells on collagen membranes. Life Sci, 18, 1139-1144 (1976)
- Sawada N, Tomomura A, Sattler CA, Sattler GL, Kleinman HK, Pitot HC. Effects of extracellular matrix components on the growth and differentiation of cultured rat hepatocytes. In Vitro, 23, 267-273 (1987)
- Mitaka T, Sattler GL, Pitot HC. Amino acid-rich medium (Leibovitz L-15) enhances and prolongs proliferation of primary cultured rat hepatocytes in the absence of serum. J Cell Physiol, 147, 495-504 (1991).
- Hasegawa K, Watanabe K, Koga M. Induction of mitosis in primary cultures of adult rat hepatocytes under serum-free conditions. Biochem Biophys Res Commun, 104, 884-891 (1982)
- Nakamura T, Teramoto H, Tomita Y, Ichihara A. L-Proline is an essential amino acid for hepatocyte-growth in culture. Biochem Biophys Res Commun, 122, 884-891.
- Mitaka T, Sattler GL, Pitot HC. The bicarbonate ion is essential for efficient DNA synthesis by primary cultured rat hepatocytes. In Vitro Cell Dev Biol, 27A, 549-556 (1991).
- Nelsen CJ, Rickheim DG, Tucker MM, McKenzie TJ, Hansen LK, Pestell RG, Albrecht JH. Amino acids regulate hepatocyte proliferation through modulation of cyclin D1 expression. J Biol Chem, 278, 25853-8 (2003)
- Kreamer BL, Staecker JL, Sawada N, Sattler GL, Hsia MTS, Pitot HC. Use of a low-speed, isodensity Percoll centrifugation method to increase the viability of isolated rat hepatocyte preparations. In Vitro, 22, 201-211 (1986)
- Mitaka T, Norioka K, Mochizuki Y. Redifferentiation of proliferated rat hepatocytes cultured in L-15 medium supplemented with EGF and DMSO. In Vitro Cell Dev Biol, 29A, 714-722 (1993)
- Isom HC, Secott T, Georgoff I, Woodworth C, Mummaw J. Maintenance of differentiated rat hepatocytes in primary culture. Proc Natl Acad Sci U S A, 82, 3252-3256 (1985)
- Kojima T, Mitaka T, Paul DL, Mori M, Mochizuki Y. Reappearance and long-term maintenance of connexin 32 in proliferated adult rat hepatocytes: Use of Serum-free L-15 Medium Supplemented with EGF and DMSO. J Cell Sci, 108, 1347-1357 (1995)
- Kojima T, Mitaka T, Shibata Y, Mochizuki Y. Induction and regulation of connexin 26 by glucagon in primary cultures of adult rat hepatocytes. J Cell Sci, 108, 2771-2780 (1995)
- Mizuguchi T, Mitaka T, Hirata K, Mochizuki Y. Alteration of expression of liver-enriched transcription factors in the transition between growth and differentiation of primary cultured rat hepatocytes. J Cell Physiol, 174, 273-284 (1998)
- Kojima T, Yamamoto M, Mochizuki C, Mitaka T, Sawada N, Mochizuki Y. Different changes in expression and junction of connexin 26 and connexin 32 during DNA synthesis and redifferentiation in primary rat hepatocytes using a DMSO culture system. Hepatology, 26, 585-597 (1997)
- Mitaka T. The current status of primary hepatocyte culture. Internat J Exp Pathol, 79, 393-409 (1998)
- Mitaka T, Sattler GL, Pitot HC, Mochizuki Y. Characteristics of small cell colonies developing in primary cultures of adult rat hepatocytes. Virchows Archiv B Cell Pathology, 62, 329-335 (1992).
- Mitaka T, Norioka K, Nakamura T, Mochizuki Y. Effects of mitogens and co-mitogens on the formation of small-cell colonies in primary cultures of rat hepatocytes. J Cell Physiol, 157, 461-468 (1993)
- Mitaka T, Norioka K, Sattler GL, Pitot HC, Mochizuki Y. Effect of Age on the Formation of Small-Cell Colonies in Cultures of Primary Rat Hepatocytes. Cancer Res, 53, 3145-3148 (1993)
- Tateno C, Yoshizato K. Growth and differentiation in culture of clonogenic hepatocytes that express both phenotypes of hepatocytes and biliary epithelial cells. Am J Pathol, 149, 1593-605 (1996)
- Sasaki K, Kon J, Mizuguchi T, Chen J, Ooe H, Oshima H, Hirata K, Mitaka T. Proliferation of hepatocyte progenitor cells isolated from adult human livers in serum-free medium. Cell Transplantation, in press (2008)
- Chen Q, Kon J, Ooe H, Sasaki K, Mitaka T. Selective proliferation of rat hepatocyte progenitor cells in serum-free culture. Nature Protocols, 2, 1197-1205 (2007)
- Tateno C, Yoshizato K. Long-term cultivation of adult rat hepatocytes that undergo multiple cell divisions and express normal parenchymal phenotypes. Am J Pathol, 148, 383-392 (1996)
- Wu JC, Merlino G, Cveklova K, Mosinger B Jr, Fausto N. Autonomous growth in serum-free medium and production of hepatocellular carcinomas by differentiated hepatocyte lines that overexpress transforming growth factor alpha 1. Cancer Res, 54, 5964-5973 (1994)
- Block GD, Locker J, Bowen WC, Petersen BE, Katyal S, Strom SC, Riley T, Howard TA, Michalopoulos GK. Population expansion, clonal growth, and specific differentiation patterns in primary cultures of hepatocytes induced by HGF/SF, EGF and TGF alpha in a chemically defined (HGM) medium. J Cell Biol, 132, 1133-1149 (1996)
- Mitaka T, Kojima T, Mizuguchi T, Mochizuki Y. Growth and maturation of small hepatocytes isolated from adult rat livers. Biochem Biophys Res Commun, 214, 310-317 (1995)
- Mitaka T, Sato F, Mizuguchi T, Yokono T, Mochizuki Y. Reconstruction of hepatic rrganoid by small hepatocytes and hepatic nonparenchymal cells. Hepatology, 29, 111-125 (1999).
- Sugimoto S, Mitaka T, Ikeda S, Harada K, Ikai I, Yamaoka Y, Mochizuki Y. Morphological changes induced by extracellular matrix are correlated with maturation of rat small hepatocytes. J Cell Biochem, 87, 16-28 (2002)
- Sudo R,Mitaka T, Ikeda S, Sugimoto S, Harada K, Hirata K, Tanishita K, Mochizuki Y. Bile canalicular formation in hepatic organoid reconstructed by rat small hepatocytes and hepatic nonparenchymal cells. J Cell Physiol, 199, 252-261 (2004)
- Oshima H, Kon J, Ooe H, Hirata K, Mitaka T. Functional expression of organic anion transporters in hepatic organoids reconstructed by rat small hepatocytes. J Cell Biochem, 104, 68-81 (2008)
- Sudo R, Kohara H, Mitaka T, Ikeda M, Tanishita K. Coordination of bile canalicular contraction in hepatic organoid reconstructed by rat small hepatocytes and nonparenchymal cells. Ann Biomed Eng, 33, 696-708 (2005)
- Pfäundler M-A S, Höchli M, Inderbitzin D, Meier PJ, Stieger B. Small hepatocytes in culture develop polarized transporter expression and differentiation. J Cell Sci, 117, 4077-4087 (2004)
- Mitaka T, Sato F, IkedaS, Sugimoto S, Higaki N, Hirata K, Lamers WH, Mochizuki Y. Expression of carbamoylphosphate synthetase I and glutamine synthetase in hepatic organoids reconstructed by rat small hepatocytes and hepatic nonparenchymal cells. Cell Tis Res, 306, 467-471 (2001)
- Miyamoto S, Hirata K, Sugimoto S, Harada K, Takeda H, Mitaka T. Expression of cytochrome P450 enzymes in hepatic organoid reconstructed by rat small hepatocytes. J Gastroenterol Hepatol, 20, 865-872 (2005)
- Kon J, Ooe H, Oshima H, Kikkawa Y, Mitaka T. Expression of CD44 in rat hepatic progenitor cells. J. Hepatology, 40, 90-98 (2006)
- Nonaka H, Tanaka M, Suzuki K, Miyajima A. Development of murine hepatic sinusoidal endothelial cells characterized by the expression of hyaluronan receptor. Dev Dyn, 236, 2258-2267 (2007)
- Mitaka T, Kojima T, Norioka K, Mochizuki Y. TGF-β completely blocks the formation of small-cell colonies: Effects of mito-inhibitory factors on the proliferation of primary cultured rat hepatocytes. Cell Struct Funct, 20, 167-176 (1995)
- Banas A, Yamamoto Y, Teratani T, Ochiya T. Stem cell plasticity: Learning from hepatogenic differentiation strategies. Dev Dyn, 236, 3228-3241 (2007)
- Ikeda S, Mitaka T, Sugimoto S, Harada K, Mochizuki Y. Proliferation of rat small hepatocytes after long-term cryopreservation. J Hepatol, 37, 7-14 (2002)
- Ooe H, Kon J, Miyamoto S, Oozone Y, Ninomiya S, Mitaka T. Cytochrome P450 expressions of cultured rat small hepatocytes after long-term cryopreservation. Drug Metab Dispos, 34, 1667-1671 (2006)










