研究交流
ヒト肝細胞を持つキメラマウスの研究利用
立野知世
株式会社フェニックスバイオ
私たちは、ヒト肝細胞をシャーレで増殖させる技術の開発を目指して研究を行ってきた。ヒト肝実質細胞をヒト血清、牛胎児血清、表皮増殖因子、ニコチンアミド、活性持続型ビタミンCを添加した培地でSwiss 3T3 細胞をフィーダーとして培養すると、コロニーを形成しながら増殖する細胞が出現する。このような細胞の割合は、わずか0.1%以下であることから、肝実質細胞に含まれる肝前駆細胞であろうと考えている。この細胞は、継代培養することが可能で、子供の肝細胞では約8回、大人の肝細胞では約4回継代培養することができる1)。しかし、シャーレでヒト肝細胞を増殖させると、肝細胞特異的な機能は低下する。このようなことから、ヒト肝細胞の機能を維持させたままin vivoで増殖させる、あるいは、in vitroで増殖させたヒト肝細胞を肝臓に移植することにより、再分化させることができるような動物モデルの作製をめざしたのが、ヒト肝細胞を持つキメラマウスを作製するきっかけとなった。2001年の肝細胞研究会において、初めてキメラマウス作製の取り組みに関して報告した。その後、毎年肝細胞研究会においてキメラマウスに関する研究の経過報告を行い、多くの先生方から貴重な意見を頂戴し、今日に至っている。
私達は、肝臓に障害を持つalbumin enhancer/promoter urokinase plasminogen activatorトランスジェニックマウス(uPAマウス)とT細胞、B細胞を持たないSCIDマウスを掛け合わせ、どちらの形質もホモ接合体であるuPA/SCIDマウスを作製した。このマウスに約100万個のヒト肝細胞を脾臓経由で移植すると、約2ヶ月で、ヒト肝細胞で置換されたキメラマウスを作製することができる2,3)。移植した肝細胞のうち約10%がuPA/SCIDマウスの類洞から肝細胞索へ侵入し、生着・増殖すると考えている。置換された肝臓は、少量のマウス肝細胞を含むが、ヒト肝細胞とマウス非実質細胞(類洞内皮細胞、星細胞、クッパー細胞など)で再構築されている(図1)。肝臓の形態を観察すると、マウス由来の類洞内皮細胞と星細胞で構築された類洞に沿って、ヒト肝細胞が配列しており、類洞には数は少ないがマウスクッパー細胞が存在している。電子顕微鏡で観察すると、マウス内皮細胞とヒト肝細胞の間にはディッセ腔が形成され、その間隙に星細胞が存在している。また、ヒト肝細胞間には、接着複合体が存在し、毛細胆管が形成されている。
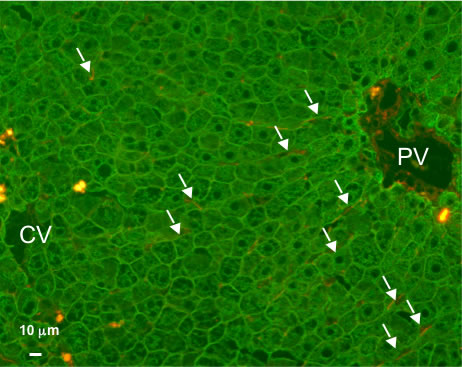
図1 ヒト肝細胞キメラマウス肝臓のヒトサイトケラチン8/18(緑、ヒト肝細胞)と
デスミン(赤、マウス星細胞、矢印)染色
PV:門脈、CV:中心静脈
最初に述べたように、uPA/SCIDマウスを作製した動機の一つは、in vitroで増殖させた肝細胞を肝臓に移植することにより、成熟肝細胞へ分化させることであった。私達は、in vitroで増殖させたヒト増殖性肝細胞をuPA/SCIDマウスに移植した。その結果、マウス肝臓に生着したヒト増殖性肝細胞はコロニーを形成しながら増殖し、最高で置換率30%に達した。in vitroにおけるヒト増殖性肝細胞は、肝細胞マーカーのアルブミンや、胆管上皮細胞のマーカーであるサイトケラチン7 (CK7)やCK19、肝幹細胞のマーカーであるCD44やThy-1を発現し、成熟肝細胞のマーカーであるトリプトファン-2,3-ジオキシゲナーゼ (TO)、グルコース-6-フォスファターゼ(G6P)は発現していなかった。ヒト増殖性肝細胞の移植後3週目ではCD44の発現が見られ、細胞のサイズは小型であった。移植後10週目になると、CK7、CK19、CD44、Thy-1の発現は消失し、細胞サイズも正常ヒト肝細胞と同等となり、TO、G6Pの発現も見られた。これらのことから、ヒト増殖性肝細胞は、in vivoにおいて成熟肝細胞に分化したと考えられた3,4)。uPA/SCIDマウスは、in vitroで増殖させたヒト肝細胞や、肝細胞に分化させたES細胞、iPS細胞などのin vivoにおける分化度を調べる研究や、正常な機能を持っているかどうか、癌化しないかなどの確認実験に利用できると考えている。
キメラマウスは、ヒト型の薬物代謝酵素、トランスポーターなどをヒトと同様なレベルで発現しているため(図2)、ヒトの薬物動態を予測することができるモデルとして使われている2,3,5-8)。シトクロームP450 (CYP)の分子種であるCYP2D6はヒトとマウスで種差があることが知られている。デブリソキンはCYP2D6の基質である。キメラマウスとコントロールマウスであるSCIDマウスにデブリソキンを投与すると、キメラマウスの血中で4’-水酸化デブリソキンが検出され、SCIDマウスでは低かった。このマウスにCYP2D6の阻害剤であるキニジンを事前に投与することにより、キメラマウス血中における4’-水酸化デブリソキンの濃度が著しく低下した8)。このことから、キメラマウスは、ヒトの薬物動態、および薬物相互作用を予測する実験モデルとして利用できることが示された。この研究は、金沢大学の横井先生との共同研究で行われた。最近、これに関する論文が、権威あるEBART Priseという賞をいただいた。
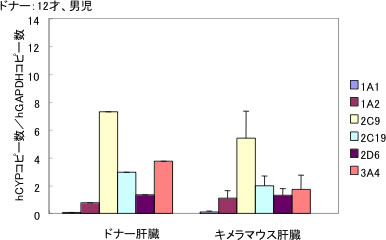
図2 ヒト肝細胞キメラマウス肝臓のCYP mRNAの発現
薬物動態試験に並んで、キメラマウスが多く研究利用されているのは、ヒト肝炎ウィルス研究分野である。現在、国内では、B型肝炎ウィルス(HBV)感染患者が150万人、C型肝炎ウィルス(HCV)感染患者が200万人いるとされている。HBVおよびHCVはヒトとチンパンジーしか感染しないことが知られている。また、in vitroでのヒト肝細胞への感染もほとんど起らない。キメラマウスはヒト肝細胞を持っているため、HBVおよびHCVが容易に感染することができる。このことは、肝炎ウィルスの研究者にとって、これまで調べることが困難であった、肝炎ウィルスの感染・増殖メカニズムや抗ウィルス剤の薬効を動物実験で調べることが可能になった事を意味する。現在、多くの肝炎ウィルス研究者により、キメラマウスが利用されている3,9-12)。
HBVには8種類のゲノタイプが知られている。ゲノタイプCに関しては、その感染は一過性であり、持続感染しないのが一般的であり、高い発癌率を示す。一方、ゲノタイプAに関しては、感染者の10%以上が持続感染することが知られている。そこで、キメラマウスに、ゲノタイプAeとCのHBVをそれぞれ接種した。その結果、どちらのゲノタイプもマウスに接種後マウス血中におけるHBV DNAコピー数が対数的に増加したが、ゲノタイプAの方がCに比べて明らかに増殖速度が遅く、また、ゲノタイプCにおいてcore proteinの高発現が見られた。このことから、ゲノタイプAeがヒトに感染した場合、宿主の免疫排除機構が低下し、その結果HBV 感染が持続するのではないかと考えられた。また、高い複製率やcore ptotein の高発現がみられたゲノタイプCは、これらの性質が高い発癌率に関与している可能性が示唆された11)。このように、病態や治療効果の異なる遺伝子型のHBVやHCVをキメラマウスに接種することにより、その病態や治療効果が異なる原因を調べることが可能となった。また、製薬会社では、新規の抗ウィルス薬の薬効をキメラマウスで確認する試験が実施されている。
ヒト肝細胞キメラマウスでは、マウスの生命活動は維持されているものの、ヒトとマウスの種差により、正常な肝臓では普通に行われている、細胞間、細胞と物質、および物質間の生体反応がうまく行われないのではないかと容易に想像がつく。マウスとヒトでは種が離れているため、タンパク質のアミノ酸配列の相同性が低いものが多く存在する。その一つの例として、成長ホルモンが挙げられる。ヒトの成長ホルモンはマウス肝細胞の成長ホルモン受容体には反応するが、マウス成長ホルモンはヒト成長ホルモン受容体には反応しない13)。肝細胞は成長ホルモン受容体を持っており、下垂体から分泌された成長ホルモンに反応して、肝細胞の増殖が促進されることが知られている。uPA/SCIDマウスにヒト肝細胞を移植後、ヒト成長ホルモンを皮下に連日投与することにより、肝細胞の増殖は促進され、マウス肝臓のヒト肝細胞による置換率は上昇した14)。
このように、ヒト肝細胞キメラマウスは、このマウスにおいて観察される異常な現象から、生体で起っている正常な反応機構を解明できるヒントを与えてくれる実験ツールとしても有用と考えている。
参考文献
- Yamasaki C, Tateno C, Aratani A, Ohnishi C, Katayama S, Kohashi T, et al.:Growth and differentiation of colony-forming human hepatocytes in vitro. J. Hepatol., 44:749-757, 2006.
- Tateno C, Yoshizane Y, Saito N, Kataoka M, Utoh R, Yamasaki C, et al. Near completely humanized liver in mice shows human-type metabolic responses to drugs. Am J Pathol 2004;165:901–912.
- 立野知世編 ヒト肝細胞キメラマウスの医学・薬学利用 細胞 40:1-41, 2008.
- Utoh R, Tateno C, Yamasaki C, Hiraga N, Kataoka M, Shimada T, e al.:Hepatitis B virus-infectibility of chimeric mice with liver repopulated by serially subcultured human hepatocytes. Hepatology, 47:435-446,2008.
- Katoh M, Matsui T., Nakajima M., Tateno C., Kataoka M., Soeno Y., Horie T., Iwasaki K., Yoshizato K., and Yokoi T.: Expression of Human CYPs in Chimeric Mice with Humanaized Liver. Drug Metab. Dispos., 32:1402-1410, 2004.
- Katoh M., Matsui T., Okamura H., Nakajima M.,Nishimura M., Naito S., Tateno C., Yoshizato K., and Yokoi T.:Expression of human phase II enzymes in chimeric mice with humanized liver. Drug Metab. Disp., 33:1333-1340, 2005.
- Katoh M, Matsui T, Nakajima M, Tateno C, Soneno Y, Horie T, et al.: In vivo induction of human cytochrome P450 enzymes expressed in chimeric mice with human hepatocytes. Drug Metab. Dispos., 33:754-763, 2005.
- Katoh M, Sawada T, Soeno Y, Nakajima M, Tateno C, Yoshizato Y, et al.: In vivo drug metabolism model for human cytochrome P450 enzyme using chimeric mice with humnanized liver J. Pharm. Sci., 96:428-437, 2007.
- Tsuge M, Hiraga N, Takaishi H, Noguchi C, Oga H, Imamura M, et al.:Infection of human hepatocyte chimeric mouse with genetially engineered hepatitis B virus. Hepatology, 42:1046-1054, 2005.
- Hiraga N, Imamura M, Tsuge M, Noguchi C, Takahashi S, Iwao E, et al.:Infection of human hepatocyte chimeric mouse with genetically engineered hepatitis C virus and its susceptibility to interferon. FEBS Lett., 581:1983-7, 2007.
- Sugiyama M, Tanaka Y, Sakamoto T, Maruyama I, Shimada T, Yakahashi S, et al.:Early dynamics of hepatitis B virus in chimeric mice carrying human hepatocytes monoinfected or coinfected with genotype G. Hepatology, 45:929-937, 2007.
- Inoue K, Umehara T, Ruegg UT, Yasui F, Watanabe T, Yasuda H, et al.:Evaluation of a cyclophilin inhibitor in hepatitis C virus-infected chimeric mice in vivo. Hepatology, 45:921-928, 2007.
- Souza SC, Frick GP, Wang X, Kopchick JJ, Lobo RB, Goodman HM. A single arginine residue determines species specificity of the human growth hormone receptor. Proc Natl Acad Sci USA1995;92:959–963.
- Masumoto N, Tateno C, Tachibana A, Utoh R, Morikawa Y, Shimada T, et al. GH enhances proliferation of human hepatocytes grafted into immunodeficient mice with damaged liver. J Endocrinol 2007;194:529-539










