ホットトピックス
肝星細胞の活性化に対する分泌経路の役割
〜CREB3L2依存的に発現上昇する分泌関連因子Sec23A/Sec24Dは肝星細胞の活性化に関与する〜
齋藤 康太
東京大学大学院薬学系研究科 生理化学教室
はじめに
肝線維化は、通常はビタミンAを貯蔵している肝星細胞が、様々な刺激によって筋線維芽細胞様に分化しI型コラーゲンの分泌を異常亢進することが要因となって発症する[1]。以前から、肝星細胞が活性化の過程で、細胞内の分泌を司る小器官である小胞体やゴルジ体を肥大化させることは知られていたが[2,3] 、肝星細胞の分泌経路に着目した研究はそれほど多くない。我々は肝星細胞の活性化に伴う小胞体からゴルジ体への輸送経路(初期分泌経路)の変化に特に着目し、興味深い知見を得たので本稿で紹介したい[4]。
コラーゲンと分泌経路
小胞体で合成された分泌タンパク質は、輸送小胞によってゴルジ体へと運ばれ、修飾された後、細胞膜より分泌される。輸送小胞は直径が60〜90 nmであるが、コラーゲンは小胞体で合成された際に、既に300 nmほどの直鎖状の構造を形成するため、通常の輸送小胞によっては分泌されない。このため、コラーゲンの分泌機構は長い間不明であった[5]。筆者らは、これまでにコラーゲンの分泌に特異的に関与する積荷受容体複合体(cTAGE5/TANGO1/Sec12)を同定し、この複合体が巨大分子コラーゲン(VII型をはじめとしたいくつかの型のコラーゲン分泌に関与する。I型の分泌に直接関与するかは議論の余地が残る)を内包できる特殊な小胞の形成に関与することを示してきた[6-14] (図1)。そこで我々は、この複合体が肝星細胞の活性化に伴って発現上昇することで、コラーゲン分泌を担っている可能性を検証するため、以下の研究を開始した。
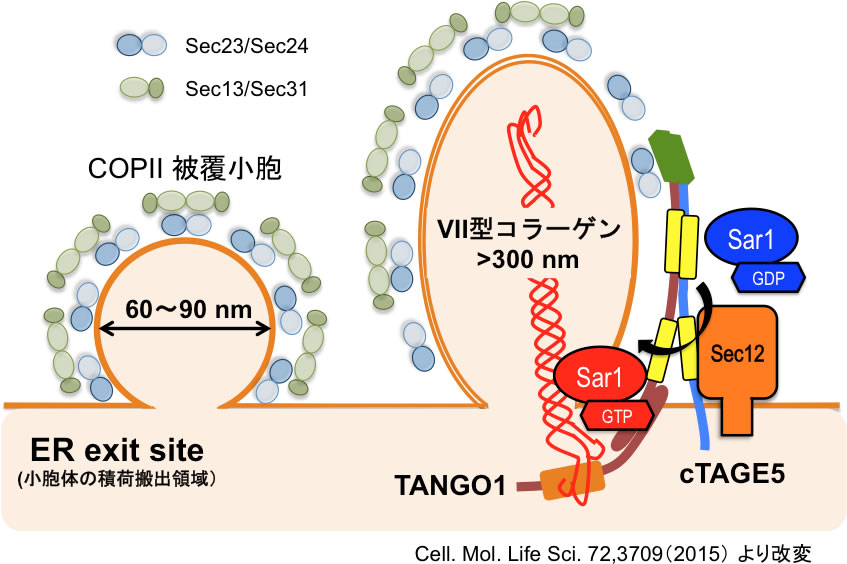
図1コラーゲン積荷受容体cTAGE5/TANGO1/Sec12複合体
cTAGE5/TANGO1/Sec12は約900kDaの複合体として存在し、cTAGE5,TANGO1は細胞質側で
被覆因子Sec23/24と、TANGO1は小胞体内腔側でコラーゲンと、それぞれ結合することにより、コラーゲン分子の小胞体からの出芽を補助する。
輸送小胞被覆因子Sec23A/Sec24Dは肝星細胞の活性化に必須である
肝星細胞の活性化に伴って初期分泌経路がどのように応答するのか、RT-PCRにより解析した。ラットから肝灌流法によって単離した肝星細胞をin vitroで培養し自己活性化させ、活性化前後での各種タンパク質の発現量を定量した。その結果、意外なことにコラーゲン積荷受容体であるcTAGE5/TANGO1/Sec12は軒並み発現量を低下させていた。一方で、輸送小胞の被覆因子であるSec23A/Sec24Dが、アイソフォーム特異的に発現上昇していることが認められた (図2A)。またこの発現上昇は、ヒト肝星培養細胞であるLX-2細胞をTGF-beta刺激し、肝星細胞活性化を模倣した際にも同様に認められた。
次にSec23AあるいはSec24Dを発現抑制した肝星細胞の活性化状態を、筋線維芽細胞マーカーであるa-SMAの発現で検討した。ラットより調製した肝星細胞に対してSec23Aを発現抑制すると、a-SMAの発現上昇が有意に低下した (図2B)。またLX-2細胞においても、Sec23AあるいはSec24Dを発現抑制することで、TGF-beta刺激によるa-SMAの活性化が抑制された。以上の結果は、Sec23A/Sec24Dが肝星細胞の活性化に必要であることを示唆している。
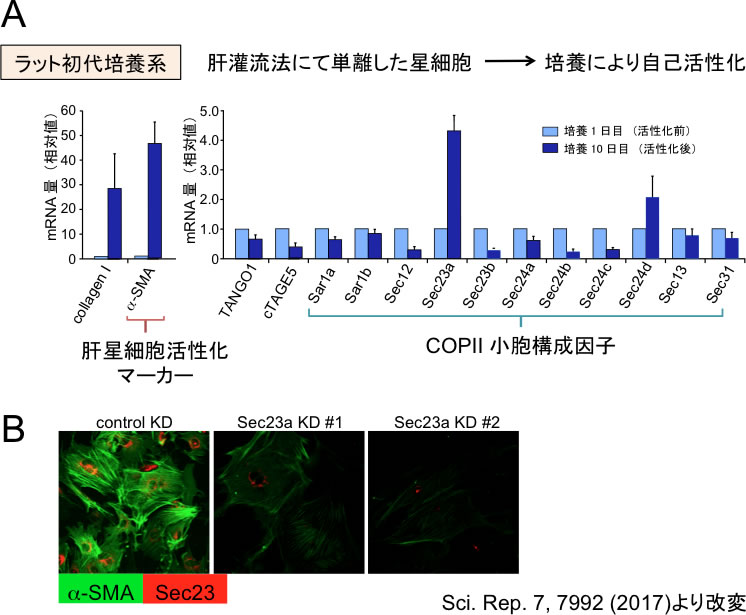
図2 Sec23Aを発現抑制すると肝星細胞の活性化が抑制される
A,ラット初代培養肝星細胞をin vitroで活性化させ、活性化前後での各種分泌関連因子の発現量変化をRT-PCRにより検証した。Sec23AおよびSec24Dの発現上昇が認められた。B,ラット初代培養肝星細胞に対してSec23aの発現抑制をしたところ、肝線維化マーカーであるa-SMAの発現が有意に低下した。
転写因子CREB3L2はSec23A/Sec24Dの発現制御に関与する
軟骨細胞や皮膚線維芽細胞において、Sec23Aの発現は転写因子であるCREB3L2/BBF2H7によって調節されることが知られている[15,16] 。そこでLX-2細胞に対しCREB3L2の発現抑制をしたところ、有意にSec23AおよびSec24Dの発現が低下し、a-SMAの発現も低下した。Sec23AとともにSec24Dの発現低下も見られたため、Sec24DもSec23Aと同様にCREB3L2の標的になっている可能性をルシフェラーゼアッセイにより検討した。その結果、Sec24DもCREB3L2によって発現が調節されていることが明らかになった。以上の結果から、CREB3L2依存的なSec23A/Sec24Dの発現上昇が肝星細胞の活性化に必要であることが明らかとなった。
COPII依存的な輸送経路は肝星細胞の活性化に必要である
Sec23A/Sec24Dは小胞体からの分泌に関与するCOPII小胞の内側被覆として機能する。またSec24にはA〜Dの4つのアイソフォームが存在し、アイソフォームの違いによって、それぞれ異なった積荷の小胞体からゴルジ体への輸送に関与することが知られている。さらにSec23A/Sec24Dに関しては、既にI型コラーゲンの分泌に関与する報告が存在する[9] 。そこで肝星細胞においても同様に、これらの因子がコラーゲン分泌に関与する可能性を検証した。しかしながら、Sec23A/Sec24Dの両者を発現抑制した細胞においても、I型コラーゲンは正常に分泌していた。以上のことから、Sec23A/Sec24Dに依存した肝星細胞の活性化に、I型コラーゲンは直接的に関与していない可能性が考えられた。
Sec23A/Sec24Dの肝星細胞活性化への寄与が、COPII小胞を介した膜輸送に依存したものであるか検証する目的で、COPII小胞の形成に関与する低分子量Gタンパク質であるSar1を発現抑制した細胞における肝星細胞の活性化を検討した。ヒトに存在する2つのSar1アイソフォーム、Sar1AおよびSar1Bを発現抑制したLX-2細胞では、TGF-beta刺激に伴うa-SMAの発現上昇が低下した。以上のことから、何らかの因子がCOPII小胞依存的に輸送されることが、肝星細胞の活性化に必要であることが明らかとなった。
次にSec23A/Sec24Dによって輸送される因子が細胞膜より分泌するか、あるいは細胞内の小器官に留まるのかを検討する目的で、Sec23A/Sec24Dを発現抑制した細胞の培養メディウムをコントロール処理群の培養メディウムと交換した。肝星細胞の活性化に必要な因子が分泌因子であった場合には、Sec23A/Sec24Dを発現抑制した細胞の培養メディウムをコントロール処理群のものと交換することによって、肝星細胞の活性化がコントロール細胞のレベルにまで回復することが考えられる。実験の結果、発現抑制した細胞をコントロール処理群由来のメディウムで培養しても、a-SMAの活性化は抑制されたままであった。以上の結果から、Sec23A/Sec24D依存的にCOPII経路を介して輸送される肝星細胞活性化責任因子は分泌されず、Sec23A/Sec24Dによって小胞体からゴルジ体へと運ばれたのちに、肝星細胞のなんらかの小器官に局在化する可能性が考えられた。
CREB3L2活性化時の小胞体からゴルジ体への輸送は、Sec23A/Sec24Dに依存しない
CREB3L2は小胞体で合成される膜貫通型の転写因子であり、小胞体からゴルジ体へと輸送され、ゴルジ体に存在するS1Pプロテアーゼによって切断されることで活性化されると考えられている。活性化した切断型CREB3L2はその後、核へ移行し、転写因子として機能する[17] 。そこで、CREB3L2の小胞体からゴルジ体への輸送にSec23A/Sec24Dが関与する可能性を検討した。しかしながら、Sec23A/Sec24Dを発現抑制した細胞においても、CREB3L2の切断は正常に起こり、CREB3L2は活性化されていると考えられた。よって、Sec23A/Sec24DはCREB3L2以外の何らかの因子を小胞体からゴルジ体へと運ぶことによって、肝星細胞の活性化に関与している可能性が示唆された。
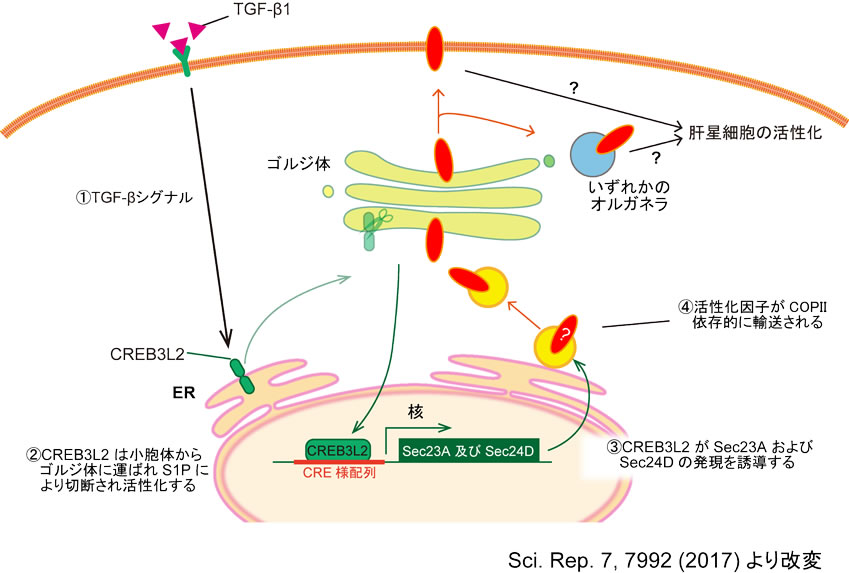
図3 Sec23A/Sec24D依存的な肝星細胞活性化機構のモデル図
考察
本研究で我々は、肝星細胞の活性化の過程でCREB3L2に依存したSec23A/Sec24Dの発現上昇が認められること、Sec23A/Sec24D依存的なCOPII小胞による小胞体からゴルジ体への輸送が肝星細胞の活性化に重要であることを示した。今回の解析ではCOPII小胞によって運ばれる肝星細胞の活性化に関与する因子の実態は同定できておらず、今後の課題である。
本研究では、肝星細胞活性化時にコラーゲンの積荷受容体複合体(cTAGE5/TANGO1/Sec12)の発現は上昇しなかったが、最近別グループより発表された知見においては、LX-2細胞をTGF-betaで刺激すると、TANGO1も発現誘導されることが報告されている[18]。矛盾するような知見に思えるが、TGF-betaの濃度が我々の実験よりも10倍濃いために、より強い小胞体ストレスによって誘導された可能性が考えられる。以上の知見を合わせると、肝星細胞はSec23A/Sec24Dを発現上昇させ、何らかの因子を小胞体からゴルジ体へと輸送することで、初期段階の活性化を受ける。その後、さらに強い小胞体ストレスを介してTANGO1の発現が誘導され、コラーゲンの分泌が亢進する可能性が考えられる。肝星細胞活性化に対する分泌経路の影響を明らかにするためには、今後もさらなる解析が必要である。
【謝辞】
一緒に研究を進めてくださった皆さま、実験方法や肝に対する最新の知見を様々ご教示いただいた東京医科歯科大学の宮村憲央先生、仁科博史先生、研究の場と環境をご提供いただいた現武蔵野大学薬学部長(東京大学名誉教授)の堅田利明先生にこの場を借りて深くお礼申し上げます。
【参考文献】
- Friedman SL (2008) Hepatic stellate cells: protean, multifunctional, and enigmatic cells of the liver. Physiological reviews 88 (1):125-172. doi:10.1152/physrev.00013.2007
- Friedman SL, Roll FJ, Boyles J, Bissell DM (1985) Hepatic lipocytes: the principal collagen-producing cells of normal rat liver. Proceedings of the National Academy of Sciences of the United States of America 82 (24):8681-8685
- Minato Y, Hasumura Y, Takeuchi J (1983) The role of fat-storing cells in Disse space fibrogenesis in alcoholic liver disease. Hepatology 3 (4):559-566
- Tomoishi S, Fukushima S, Shinohara K, Katada T, Saito K (2017) CREB3L2-mediated expression of Sec23A/Sec24D is involved in hepatic stellate cell activation through ER-Golgi transport. Scientific reports 7 (1):7992. doi:10.1038/s41598-017-08703-6
- Fromme JC, Schekman R (2005) COPII-coated vesicles: flexible enough for large cargo? Current opinion in cell biology 17 (4):345-352. doi:10.1016/j.ceb.2005.06.004
- Maeda M, Katada T, Saito K (2017) TANGO1 recruits Sec16 to coordinately organize ER exit sites for efficient secretion. The Journal of cell biology 216 (6):1731-1743. doi:10.1083/jcb.201703084
- Maeda M, Saito K, Katada T (2016) Distinct isoform-specific complexes of TANGO1 cooperatively facilitate collagen secretion from the endoplasmic reticulum. Molecular biology of the cell 27 (17):2688-2696. doi:10.1091/mbc.E16-03-0196
- Saito K, Chen M, Bard F, Chen S, Zhou H, Woodley D, Polischuk R, Schekman R, Malhotra V (2009) TANGO1 facilitates cargo loading at endoplasmic reticulum exit sites. Cell 136 (5):891-902. doi:10.1016/j.cell.2008.12.025
- Saito K, Katada T (2015) Mechanisms for exporting large-sized cargoes from the endoplasmic reticulum. Cellular and molecular life sciences : CMLS 72 (19):3709-3720. doi:10.1007/s00018-015-1952-9
- Saito K, Yamashiro K, Ichikawa Y, Erlmann P, Kontani K, Malhotra V, Katada T (2011) cTAGE5 mediates collagen secretion through interaction with TANGO1 at endoplasmic reticulum exit sites. Molecular biology of the cell 22 (13):2301-2308. doi:10.1091/mbc.E11-02-0143
- Saito K, Yamashiro K, Shimazu N, Tanabe T, Kontani K, Katada T (2014) Concentration of Sec12 at ER exit sites via interaction with cTAGE5 is required for collagen export. The Journal of cell biology 206 (6):751-762. doi:10.1083/jcb.201312062
- Tanabe T, Maeda M, Saito K, Katada T (2016) Dual function of cTAGE5 in collagen export from the endoplasmic reticulum. Molecular biology of the cell 27 (13):2008-2013. doi:10.1091/mbc.E16-03-0180
- Ge L, Zhang M, Kenny SJ, Liu D, Maeda M, Saito K, Mathur A, Xu K, Schekman R (2017) Remodeling of ER-exit sites initiates a membrane supply pathway for autophagosome biogenesis. EMBO reports. doi:10.15252/embr.201744559
- Saito KM, M.; Katada, T. (2017) Regulation of the Sar1 GTPase Cycle Is Necessary for Large Cargo Secretion from the Endoplasmic Reticulum. Frontiers in Cell and Developmental Biology 5:75. doi:10.3389/fcell.2017.00075
- Ishikura-Kinoshita S, Saeki H, Tsuji-Naito K (2012) BBF2H7-mediated Sec23A pathway is required for endoplasmic reticulum-to-Golgi trafficking in dermal fibroblasts to promote collagen synthesis. The Journal of investigative dermatology 132 (8):2010-2018. doi:10.1038/jid.2012.103
- Saito A, Hino S, Murakami T, Kanemoto S, Kondo S, Saitoh M, Nishimura R, Yoneda T, Furuichi T, Ikegawa S, Ikawa M, Okabe M, Imaizumi K (2009) Regulation of endoplasmic reticulum stress response by a BBF2H7-mediated Sec23a pathway is essential for chondrogenesis. Nature cell biology 11 (10):1197-1204. doi:10.1038/ncb1962
- Kondo S, Saito A, Hino S, Murakami T, Ogata M, Kanemoto S, Nara S, Yamashita A, Yoshinaga K, Hara H, Imaizumi K (2007) BBF2H7, a novel transmembrane bZIP transcription factor, is a new type of endoplasmic reticulum stress transducer. Molecular and cellular biology 27 (5):1716-1729. doi:10.1128/MCB.01552-06
- Maiers JL, Kostallari E, Mushref M, deAssuncao TM, Li H, Jalan-Sakrikar N, Huebert RC, Cao S, Malhi H, Shah VH (2017) The unfolded protein response mediates fibrogenesis and collagen I secretion through regulating TANGO1 in mice. Hepatology 65 (3):983-998. doi:10.1002/hep.28921