ホットトピックス
YAP1/TAZおよびTGFβ経路を介したMOB1A/1B欠損による肝がん発症機構
西尾美希、鈴木 聡
九州大学 生体防御医学研究所 ゲノム腫瘍学
Hippo経路は、細胞レベルでは接触抑制などを制御し、個体レベルでは器官サイズや腫瘍の発症・進展制御に関わる経路として注目されている。私たちはHippo経路のコアコンポーネントの一つであるMOB1A/1Bに着目し、肝臓において、1)MOB1A/1Bはほ乳類Hippo経路のハブの機能として重要であること、2)MOB1A/1B欠損マウスの表現型はYAP1に強く依存し、TAZやTGFβ経路にも部分的に依存していること、3)MOB1A/1B欠損(YAP1の活性化)は、肝がんのなかでも特に肝内胆管がんや混合性肝がんの一因となること、4)抗寄生虫薬イベルメクチンはin vitroとin vivoにおいてYAP1の活性を抑制することを見出し、これらから、肝内胆管がんや混合性肝がんに対して、Hippo 経路を標的とした薬剤が新たな抗腫瘍薬として奏功する可能性を示した(文献1)。
Hippo経路はショウジョウバエにおいて、器官のサイズを制御するシグナル経路として初めて同定され、ほ乳類相同分子も同定された。ほ乳類Hippo経路はMSTキナーゼ/LATSキナーゼとそのアダプター分子SAV1/MOBの4つをコアコンポーネントとし、細胞密度、細胞外基質の硬度や機械的外力などによって制御される(図1)。Hippo経路は刺激を受けて活性化すると下流の転写共役因子YAP1/TAZをリン酸化する。リン酸化されたYAP1/TAZは、14-3-3と結合することで細胞質に排出される、あるいはタンパク質崩壊をうけることで、転写因子TEADの活性が低下する。すなわち、YAP1/TAZは細胞増殖に正に働き、Hippoコアコンポーネントはこれを負に制御する。これまでに作製された肝臓特異的なHippo経路変異(NF2,SAV1,MST1/2欠損およびYAP1 Tg)マウスにおいて、腫瘍形成をみることからHippo経路が肝がんの発症進展に重要であることは知られている(文献2)。しかしながら、ほ乳類Hippo経路には多くの相同分子が存在するため、発生過程や各組織の生理的作用においてどのHippo経路分子がどのような役割を担っているかを明らかにする必要がある。
MOBには7つの相同分子が存在するが、MOB1AとMOB1BのみがLATSと結合し、LATSのキナーゼ活性を強力に増強する。私たちはこれまでにMOB1A/1Bは発生に重要であり、がん抑制遺伝子として作用することを報告した(文献3)。次に、肝臓においてMOB1A/1Bと他のHippo経路分子の作用を比較するため、肝臓特異的なMOB1A/1B欠損マウスを作製した。
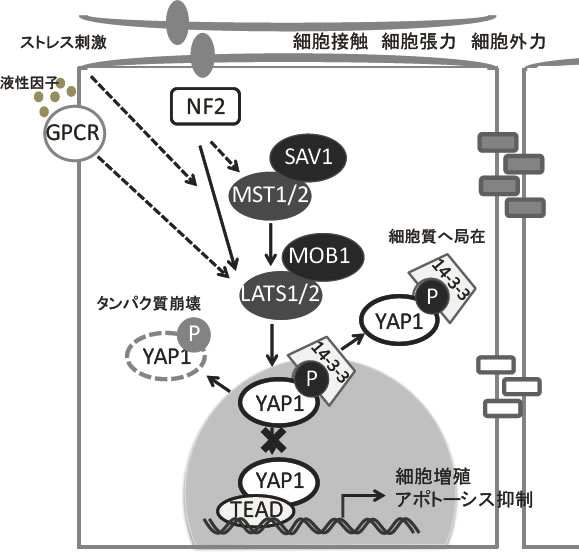
図1 ほ乳類Hippo経路図
ほ乳類Hippo経路は細胞接触などにより活性化され、下流の転写共役因子YAP1をリン酸化する。リン酸化したYAP1は14-3-3と結合することで核から排除、あるいはタンパク質崩壊をうける。核内のYAP1が減少すると転写因子TEADの活性が低下し、細胞増殖に対して負に作用する。
肝臓特異的なMOB1欠損マウスは、オーバル細胞や未分化胆管細胞の過形成により生後早期に死亡するか、混合型肝がんや肝内胆管がんを発症して死亡する
肝臓特異的にMOB1A/1Bを欠損させたマウスでは生後10日から肝腫大が観察され、生後21日までには半数以上が死亡した(図2A)。マウスは黄疸を呈し(図2B)、死因は肝機能障害によると考えられた。経時的にみると、生後0日では正常マウスと差を認めないものの、生後7日からCK19、CK7(胆管細胞マーカー)陽性の未分化な胆管細胞の急激な増生が観察され、その一部はA6、TROP2陽性のオーバル細胞であった(図2C)。さらに肝細胞数は激減するとともに一部はAFP陽性であった。その他、炎症細胞浸潤、線維化亢進なども観察された。
これら肝臓の表現型が軽微なマウスは長期生存するものの、17週齢には多くのマウスで腫瘍を形成し、60週齢以内に混合性肝がんや肝内胆管がんで全例死亡した(図2D)。これらMOB1A/1B欠損マウスの表現型は、これまでに作製されたHippo経路分子変異マウスのうちで最も劇的であった。
また、MOB1A/1B欠損細胞では細胞増殖亢進、細胞飽和密度の上昇、肝細胞から未分化な胆管細胞への脱分化、上皮間葉転換、細胞遊走能の亢進を認め、これらが肝臓細胞の腫瘍化に寄与したものと思われる。
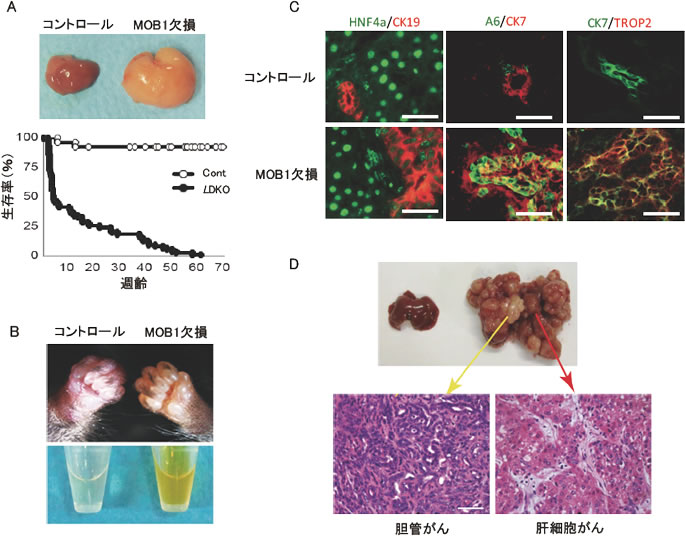
図2 肝臓特異的なMOB1A/1B欠損マウスの表現型
肝臓特異的MOB1欠損マウスにみられる(A)肝腫大(生後10日)と早期致死、(B)黄疸症状(生後14日)、(C)CK7、CK19陽性の未分化な胆管細胞やA6、TROP2陽性のオーバル細胞の増生、(D)長期生存マウスにみられる混合性肝がんや肝内胆管がんの発症
肝臓特異的MOB1欠損マウスの表現型はYAP1/TAZ およびTGFβ経路に依存する
TGFβは細胞増殖、細胞死、細胞分化、線維化を制御すること、正常な上皮細胞ではTGFβは増殖抑制に作用するが、腫瘍進展の過程においては抑制にも亢進にも作用することなどが報告されている。
生化学的には、MOB1A/1B欠損マウスオーバル細胞株やマウス肝臓においてYAP1/TAZの発現増加、リン酸化YAP1/TAZの発現減少、YAPの核局在亢進を認めた。また、YAP1の下流標的分子であるCTGF、 SPP1、JAG1、TGFβ2/3の発現が亢進し、TGFβ2/3の下流で作動するSMAD2/3のリン酸化増加と核局在の亢進も認めた。
次に、MOB1A/1B欠損マウス肝臓でみられる表現型がYAP1、TAZ、TGFβRceptor2あるいはCTGFのどの分子に依存しているかを、三重欠損マウス作製し検討した。MOB1A/1B欠損マウスにみられた肝重量の増加、未分化胆管細胞の増生、線維化の亢進は、YAP1をさらに欠損させることでほぼ抑制され、TAZやTGFβRceptor2欠損でも部分的に抑制されたが、CTGF欠損では変化はみられなかった。このようにMOB1A/1B欠損マウスの肝臓の表現型はほぼYAP1に依存し、TAZやTGFβsにも一部依存することを見出した(図3)。
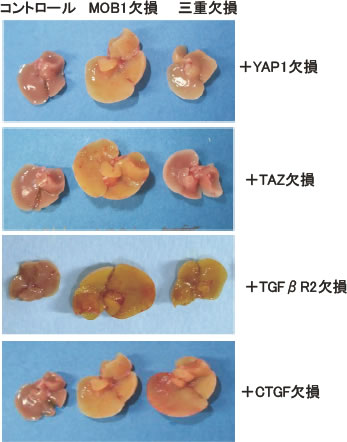
図3 肝臓特異的なMOB1A/1B欠損マウスのYAP1依存性
MOB1欠損プラスYAP1、TAZ、TGFβRceptor2、CTGF欠損肝臓の肉眼的所見
Hippo経路の破綻はヒト肝内胆管がんや混合型肝がんの一因であり、YAPを抑制するイベルメクチンは胆管がん細胞株に対して抗腫瘍効果を示す。
ヒト肝がん標本では、特に肝内胆管がんや混合型肝がんにおいて、YAP1の発現が顕著に亢進していた。この結果とマウスにみられた結果から、ヒト肝内胆管がんや混合型肝がんの一因は、Hippo経路の破綻であることが明らかとなった。またYAP1の発現とSMAD2の活性化には正の相関をみとめた。
次にYAP1の活性抑制薬が、胆管がんや混合型肝がんの治療薬になりうる可能性が示唆されたため、天然化合物ライブラリーをスクリーニングし、YAP1の活性を抑制する天然化合物として、抗寄生虫薬イベルメクチンやミルベマイシンを得た。これら薬剤はin vitroではYAP1の発現や活性化の抑制、YAP1下流転写標的であるCTGFの発現減弱、細胞増殖抑制を示した。またin vivoにおいては肝臓特異的MOB1A/1B欠損マウスにみられる胆管増生や腫瘍形成を顕著に抑制し(図4A)、ヌードマウスに胆管がん細胞株を皮下移植した腫瘍に対しても増殖抑制効果を示した(図4B)。
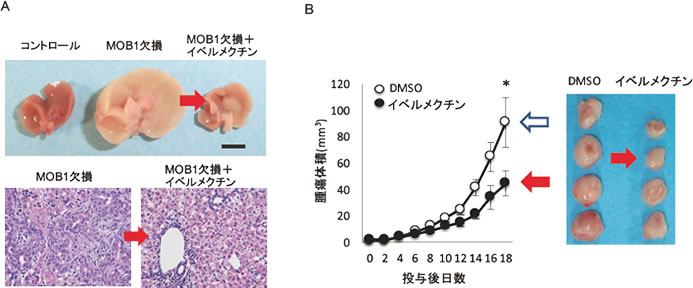
図4 イベルメクチンの抗腫瘍薬としての可能性
抗寄生虫薬イベルメクチンによる(A)肝臓特異的MOB1欠損マウスの表現型の抑制、(B)胆管がん細胞株皮下移植後の腫瘍増殖抑制効果
おわりに
本研究によってMOB1A/1Bが肝臓の恒常性の維持に重要であること、肝がんの、特に肝内胆管がんおよび混合型肝がんの発症の一因であること、さらにHippo経路を標的する天然化合物イベルメクチンがこれら腫瘍の治療薬として奏功する可能性があることを示した。
今後さらにHippo経路の生理作用やその破綻疾患を解明していきたい。
引用文献
- Nishio M, Sugimachi K, Goto H, Wang J, Morikawa T, Miyachi Y, Takano Y, Hikasa H, Itoh T, Suzuki SO, Kurihara H, Aishima S, Leask A, Sasaki T, Nakano T, Nishina H, Nishikawa Y, Sekido Y, Nakao K, Shin-ya K, Mimori K, Suzuki A. Dysregulated YAP1/TAZ and TGF-beta signaling mediate hepatocarcinogenesis in Mob1a/1b-deficient mice. PROCEEDINGS OF THE NATIONAL ACADEMY OF SCIENCE USA 113 (1), E71-80, 2016.
- 後藤裕樹、西尾美希、杉町圭史、三森功士、鈴木 聡
Hippo経路と腫瘍-Hippo経路変異によるがんモデルマウス-
医学のあゆみ 251(5), 428-435, 2014. - Nishio M, Hamada K, Kawahara K, Sasaki M, Noguchi F, Chiba S, Mizuno K, Suzuki SO, Dong Y, Tokuda M, Morikawa T, Hikasa H, Eggenschwiler J, Yabuta N, Nojima H, Nakagawa K, Hata Y, Nishina H, Mimori K, Mori M, Sasaki T, Mak TW, Nakano T, Itami S, Suzuki A. Cancer susceptibility and embryonic lethality in Mob1a/1b double-mutant mice. JOURNAL OF CLINICAL INVESTIGATION 122 (12), 4505-18, 2012.










