ホットトピックス
肝疾患治療に対する細胞移植研究の強力なツール:バイオイメージングラット
芳賀純子、小林英司
慶應義塾大学
近年、肝疾患治療の一つとして、細胞移植が再注目されている。古くは代謝性肝疾患に対してアロ肝細胞移植が行われてきた。一方、近年の幹細胞研究の進歩により、移植細胞として肝細胞や骨髄細胞を用いる研究から、自己幹細胞から誘導した肝(前駆)細胞や間葉系幹細胞(Mesenchymal Stem Cell:MSC) を代表とする研究へと広がっている。iPS細胞は細胞ソースとして大きな注目を集めているが、現在の課題は、誘導細胞の安全性のみならず、細胞移植自体の生着率等の乗り越えるべき課題がある。
これまでのマウス・ラットを用いた肝切除モデルでは、残存する肝細胞が成熟し、分化や肥大することにより、肝臓の大きさを回復するため、投与した肝細胞がどれほど残るか不明であった。一方、肝臓が機能を失った末期肝不全、特に肝硬変モデルでの細胞移植研究が行われるようになった。肝硬変下では、肝細胞自体の増殖がなく、未分化な細胞が分化することで肝再生が生じると考えられている。著者らは拒絶反応の危険性を回避できると考えられるMSCに注目してきた。MSCは、ES細胞のようにヒトの胚を破壊することなく入手可能であり、iPS細胞のように遺伝子や薬物等による分化誘導も不要であるというメリットがある。
細胞治療の研究が様々な幹細胞・疾患モデルを用いて行われているが、移植細胞の動態を適切に可視化することが重要となる。著者らは、これまで多くのバイオイメージング研究に役立つラットを作製してきた(教室ホームページ)。本トピックスでは、これらのラットを使用した肝疾患治療に対する細胞移植研究を紹介する。
アルブミンは肝細胞により特異的に産生されるため、アルブミン産生細胞を見ることができるシステムは、機能を失った肝臓に移植した細胞が肝細胞として機能することを可視化により評価できる価値あるツールである。著者らは2003年、肝細胞で特異的に活性化するアルブミンエンハンサー/プロモーターの制御下で,サンゴ由来の変異赤色蛍光タンパク質(DsRed2)を発現するAlb-DsRed2ラットを報告した(文献1)。四塩化炭素による急性肝障害および慢性肝障害モデルにAlb-DsRed2ラットの骨髄を経門脈投与した。急性肝障害モデル(図1A)に比べ慢性肝障害モデル(図1B)においてDs-Red2陽性アルブミン産生細胞数が増加し、細胞の大きさも増大した。DsRed2はアルブミンを産生する際に肝細胞が蛍光観察下で赤く見えるため、機能を失った肝臓に生着した移植細胞が肝細胞に分化し、アルブミンを産生したかどうかを捉えることが可能であった。
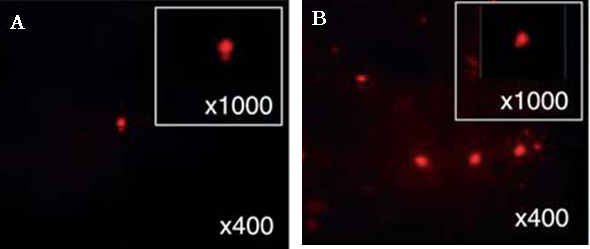
図1. 急性障害時(A)及び慢性障害時(B)のDsRed2発現(文献1より改変)
さらに2006年には、生物発光酵素であるルシフェラーゼ(luciferase)を遺伝子導入したラット(luc-Tgラット)を世界で初めて報告した(文献2)。luc-TgラットはRosa26プロモーターを使い、全ての臓器と組織に強力にルシフェラーゼを発現させた。ルシフェラーゼは長期間観察可能である利点を活かして、移植した成熟肝細胞の発生運命を評価した。luc-Tgラットから採取した肝細胞は強いルシフェラーゼ活性を示した(図2A、B)。このluc-Tgラットの肝細胞を3分の2肝切除LEWラットに対し経門脈投与した。その結果、正常肝ラットでは1週間で移植細胞が消失するが、肝切除モデルラットでは2ヶ月以上経過しても発光強度が認められた(図2C)。移植された肝細胞は肝再生下において肝臓内にとどまり、維持される事が示された。
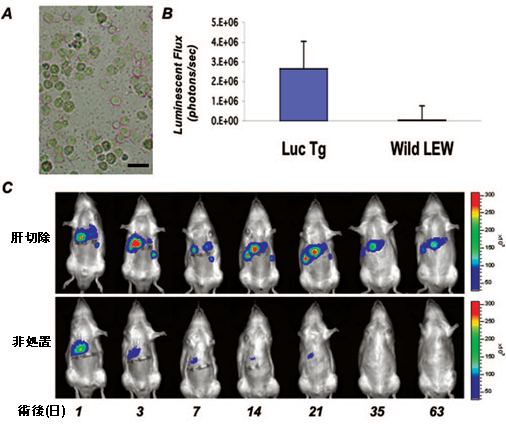
図2 肝切除モデルラットへのluc肝細胞移植(文献2より改変)
A: 分離直後のluc-Tgラット肝細胞。
B: Wildタイプの肝細胞とluc-Tgラットの肝細胞におけるルミネッセンス輝度。
C: 肝切除(上段)及び正常(下段)モデルへのluc-Tgラットの投与後経過。
一方、肝細胞移植の対象となる代謝性疾患と異なり(文献3)、肝臓が機能を十分に果たせなくなった非代償性肝硬変の治療として、骨髄細胞移植が注目されてきた(文献4)。しかし、骨髄細胞移植の治療上の問題点として、十分な移植細胞数の確保や移植回数、さらに投与ルートがあった。そこで著者らは2007年に、四塩化炭素投与によるラット肝硬変モデルを作成し、イメージングラットから採取した骨髄細胞の移植治療効果を検討した。まず、細胞治療においては、移植細胞が高率に障害を受けた臓器に生着し機能を改善させることが重要となるため、至適投与方法の検討を行った(文献5)。始めに、正常肝LEWラット及び、四塩化炭素による障害肝LEWラットにGreen Fluorescent Protein(GFP)ラットから採取した骨髄細胞1-4×108個を門脈より投与した。CCDカメラで観察(文献6)した結果、正常肝に比べ障害肝において、より多くのGFP陽性細胞を認めた(図3A) 。次に、ポート付きカテーテルを挿入し、門脈への複数回投与を行った(図3B)。骨髄細胞を末梢から投与すると、移植細胞の多くは肺へ集積され、障害肝まで辿り着く細胞が少ない。一方、門脈への直接投与時には、障害肝へ大量の細胞が集積することが判明した。経門脈複数回投与によって、骨髄細胞非投与群に比べ骨髄細胞投与群において、肝線維化の改善と(図3C)、アルブミンを産生しないレシピエントラット、Nagase analbuminemic rat (NAR)の肝臓にアルブミン産生細胞を認めた(図3D)。骨髄細胞を経門脈複数回投与することにより、肝硬変に対する治療効果の可能性が示された。門脈への直接投与は、臨床応用の際でも、門脈カテーテルを用いることにより実現可能であると考えられた。
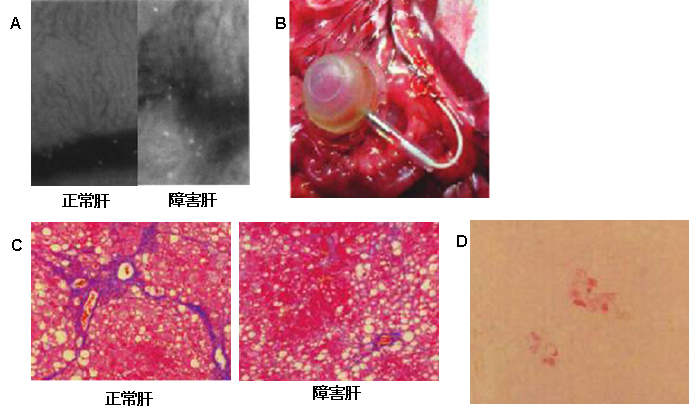
図3 肝硬変モデルラットへのGFP陽性骨髄細胞移植(文献5より改変)
A: CCDカメラ撮影による正常肝及び障害肝内のGFP陽性細胞。
B: 門脈に挿入したポート付2Frシリコンカテーテル。
C: 正常肝及び障害肝のアザン染色による線維化の評価。
D: アルブミン染色によるアルブミン産生細胞の同定。
2014年7月には、厚生労働省の科学技術部会は、山口大学医学部附属病院から申請されていた坂井田、寺井らによるヒト体性幹細胞を用いる臨床研究の実施計画を了承した。この研究は、進行した非代償性肝硬変の患者から局所麻酔下に骨髄液を約30ml採取し、それを培養装置内で約3週間培養して骨髄間葉系幹細胞を含む細胞群を増やし、品質・規格・安全性の評価を行った後、その細胞を懸濁液として、採取された患者の腕の静脈から点滴投与により体内に戻すというものであった。その中で、重症患者の治療上の問題として、骨髄細胞の採取は負担が大きいことが明らかとなってきた。著者らは、増幅可能な体性幹細胞としてMSCによる肝再生の検討を行ってきた(文献7)。細胞ソースとしては骨髄由来MSCの歴史が古いが、皮下脂肪由来MSCが採取の点でも注目が集まっていた。虚血再灌流後の肝切除モデルラットにluc-Tgラットから採取した脂肪組織由来MSCを経門脈投与した。投与1日後では多くのMSCが残肝に残るが、時間と共に減少することが生体イメージングで確認できた(図4)。MSCは肝細胞のアポトーシスを抑制し、再生を促進する。骨髄由来MSCは腸骨から採取した骨髄液を用いるが、皮下脂肪由来MSCは侵襲の少ない方法で採取可能な皮下脂肪を用いるため、患者にとっての負担が少なく、低侵襲で個別化された医療の実現が期待できると考えられた。
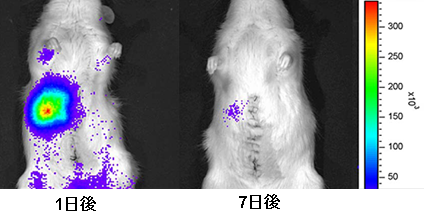
図4 残肝におけるルシフェラーゼ活性(文献7より改変)
IVIS(In Vivo Imaging System)による残肝内MSC細胞の変化。
細胞移植では、効果的により多くの細胞を投与できるかが重要となるが、イメージングラットによる検討で移植細胞の動態を把握することが可能である。本細胞トレースシステムは、すでに世界にコンソーシアムを組んでおり、バイオイメージングラットから分離した幹細胞を用いた細胞移植における種々の変化を種々の疾患モデルで国際レベルの共同研究へと展開している(文献8、9)。
関連文献
- Sato Y, Igarashi Y, Hakamata Y, Murakami T, Kaneko T, Takahashi M, Seo N, Kobayashi E. Establishment of Alb-DsRed2 transgenic rat for liver regeneration research. Biochem Biophys Res Commun. 2003; 311: 478-481.
- Hakamata Y, Murakami T, Kobayashi E. “Firefly rats” as an organ/cellular source for long-term invivo bioluminescent imaging. Transplantation. 2006; 81: 1179-1184.
- Enosawa S, Horikawa R, Yamamoto A, Sakamoto S, Shigeta T, Nosaka S, Fujimoto J, Tanoue A, Nakamura K, Umezawa A, Matsubara Y, Matsui A, Kasahara M. Hepatocyte transplantation using a living donor reduced graft in a baby with ornithine transcarbamylase deficiency: A novel source of hepatocytes. Liver Transpl. 2013; 20: 391-393.
- Terai S, Ishikawa T, Omori K, Aoyama K, Marumoto Y, Urata Y, Yokoyama Y, Uchida K, Yamasaki T, Fujii Y, Okita K, Sakaida I. Improved liver function in patients with liver cirrhosis after autologous bone marrow cell infusion therapy. Stem Cells. 2006; 24: 2292-8.
- Haga J, Wakabayashi G, Shimazu M, Tanabe M, Takahara T, Azuma T, Sato Y, Hakamata Y, Kobayashi E, Kitajima M. In vivo visualization and portally repeated transplantation of bone marrow cells in rats with liver damage. Stem Cells Dev. 2007; 16: 319-328.
- Enomoto A, Kikuchi T, Seo N, Matsuno K, Kobayashi E. Impact of cold preservation on leukocyte adhesion to the transplanted rat lung. Microsurgery. 2007; 27: 228-233.
- Kanazawa H, Fujimoto H, Teratani T, Iwasaki J, Kasahara N, Negishi K, Tsuruyama T, Uemoto S, Koabayashi E. Bone marrow-derived mesenchymal stem cells ameliorate hepatic ischemia reperfusion injury in a rat model. PLoS One. 2011; 6: 19195.
- Doorschodt BM, Teubner A, Kobayashi E, Tolba RH. Promising future for the transgenic rat in transplantation research. Transplant Rev (Orlando). 2014; pii S0955-470
- Zhou SB, Chiang CA, Xie Y, Li H, Liu K, Kobayashi E, Li QF. In vivo bioimaging analysis of stromal vascular fraction-assisted fat grafting: the interaction and mutualism of cells and grafted fat. Transplantation. 2014; 98: 1048-55.










