ホットトピックス
質量顕微鏡を用いた肝細胞癌脂質代謝異常の解析
瀬藤光利
浜松医科大学解剖学講座(細胞生物学分野)
質量顕微鏡法
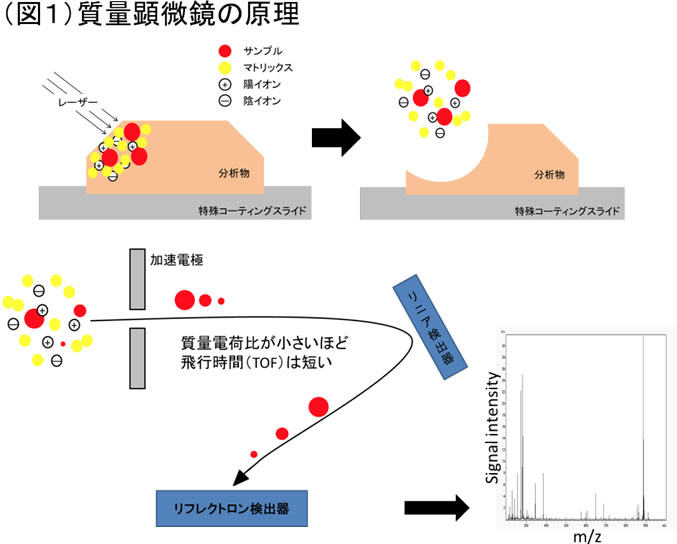
質量分析法(MS; mass spectrometry)とは、様々な分子やクラスターなどをイオン化し、その質量電荷比(m/z)の違いに応じて分子量を同定する方法である。これによりプロテオーム、リピドーム解析などの分野は飛躍的な発展を遂げている。質量顕微鏡法は、試料の持つ位置情報を保持したまま、この質量分析を可能にした解析方法であり、従来の質量分析では不可能であった生体試料内での物質の分布を可視化することに成功した。一般的には、試料にマトリックスを塗布後、レーザーでイオン化するマトリックス支援レーザー脱離イオン化(Matrix Assisted Laser Desorption Ionization : MALDI)法が質量顕微鏡法では用いられている。イオン化したタンパク、脂質などは、その物質の質量電荷比m/zにより分析装置内での飛行時間(TOF: time of flight)が異なるため分離が可能となる(図1)。質量顕微鏡は脂質の同定にも優れた分析法であり、現在ヒトやマウスの生体試料を用いた解析に多く用いられている。肝臓は生体内でも主要な脂質代謝臓器であり、様々な脂質の解析が行われる。
肝細胞癌と質量顕微鏡
肝細胞癌の原因としてウイルス感染やアルコールなどによる慢性炎症からの肝障害、種々のストレス(酸化ストレス、小胞体ストレス)、p53遺伝子変異、microRNAやepigeneticな変化などがあげられる[1]。慢性炎症による肝障害は肝細胞で持続的にアポトーシスと肝再生を引き起こしprogenitor cellの活性化から発癌に寄与する可能性が示唆される[2] [3]。近年メタボリックシンドロームを背景とした脂肪肝からの肝細胞癌が増加しており、脂質代謝異常もまた、発癌に関与する因子として注目されている。脂質の解析には様々な質量分析法が用いられるが、質量顕微鏡を用いたイメージングは可視化による肝細胞癌の脂質代謝異常のメカニズム解明に有用と考える。
肝細胞癌における脂質組成変化
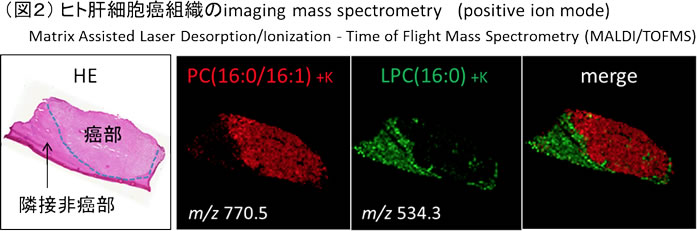
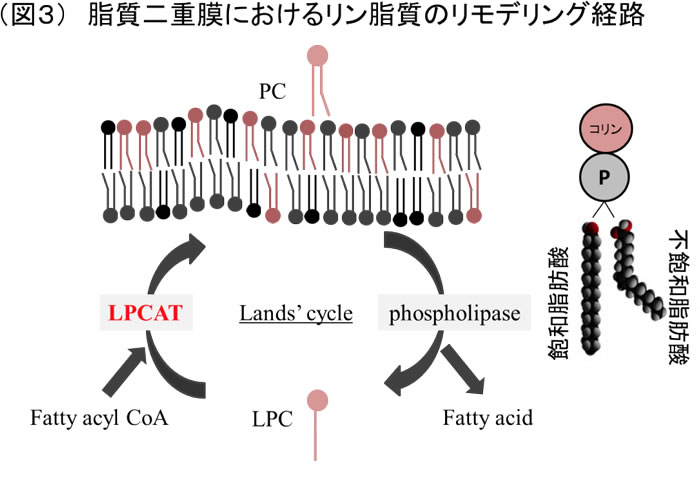
ホスファチジルコリンPCは形質膜を構成するリン脂質として比較的豊富に存在し、グリセロール骨格にコリンと2つの脂肪酸で構成される。アシル鎖の脂肪酸の種類により様々なPC分子種が存在するが、この合成は主にリモデリング経路(Land’s cycle)によることが知られている[4]。リモデリングによるリン脂質組成の変化は、脂質二重膜における種々のシグナル伝達や、形態学的変化に重要な役割を果たしている[5]。我々はヒト肝細胞癌組織を用いた質量顕微鏡による解析を行い、癌部と隣接非癌部でPCの組成が変化していることを報告した[6]。すなわち癌部ではPC(16:0/16:1)が上昇し、このPCから一価の不飽和脂肪酸MUFAであるパルミトレイン酸C16:1が外れたリゾ体であるリゾホスファチジルコリンLPC(16:0)が低下していた(図2)。脂質二重膜では図3のようにリン脂質のリモデリングが行われているとされ、PCに関してはゾホスファチジルコリンアシルトランスフェラーゼLPCATにより(LPCと脂肪酸から)PCが合成、ホスホリパーゼによりPCが加水分解され、アラキドン酸などの脂肪酸が遊離する。このような経路が膜のリン脂質の組成を変化させ、膜の流動性やシグナル伝達に変化をもたらすと考えられる。今回、肝細胞癌臨床検体では癌部においてLPCAT1遺伝子、タンパク発現が有意に上昇していた。LPCAT1は大腸癌[7]や前立腺癌[8]において悪性度に関与することが報告されている。我々もHepG2, Huh7肝癌細胞株においてLPCAT1発現はその増殖能、浸潤能を増加させることを確認した。LPCAT1はリン脂質の組成を変化させるとともに血小板活性化因子PAFも合成することが知られており[9]、リン脂質の組成変化と共に炎症性メディエイターを介した肝細胞癌悪性度に関与することが示唆される。
このようにイメージングから得られる脂質の解析は肝細胞癌のmalignant behaviorを知る糸口ともなり得る。
おわりに
質量顕微鏡の最大の利点は位置情報を失わずに、組織中の物質の多寡を可視化できることである。現在、光学顕微鏡で観察した資料を直接質量分析でき、最大5μmの高解像度イメージングを有する質量顕微鏡(Shimadzu社 iMScope)が開発されている。連続切片を作成することで免疫組織学的評価との照らし合わせもでき、臨床の様々な場面でも質量顕微鏡の活躍が期待される。
参考文献
- Farazi, P.A. and R.A. DePinho, Hepatocellular carcinoma pathogenesis: from genes to environment. Nat Rev Cancer, 2006. 6(9): p. 674-87.
- Roskams, T., Liver stem cells and their implication in hepatocellular and cholangiocarcinoma. Oncogene, 2006. 25(27): p. 3818-22.
- He, G., et al., Identification of liver cancer progenitors whose malignant progression depends on autocrine IL-6 signaling. Cell, 2013. 155(2): p. 384-96.
- Lands, W.E., Metabolism of glycerolipides; a comparison of lecithin and triglyceride synthesis. J Biol Chem, 1958. 231(2): p. 883-8.
- Hishikawa, D., et al., Discovery of a lysophospholipid acyltransferase family essential for membrane asymmetry and diversity. Proc Natl Acad Sci U S A, 2008. 105(8): p. 2830-5.
- Morita, Y., et al., Lysophosphatidylcholine acyltransferase 1 altered phospholipid composition and regulated hepatoma progression. J Hepatol, 2013. 59(2): p. 292-9.
- Mansilla, F., et al., Lysophosphatidylcholine acyltransferase 1 (LPCAT1) overexpression in human colorectal cancer. J Mol Med (Berl), 2009. 87(1): p. 85-97.
- Zhou, X., et al., The expression level of lysophosphatidylcholine acyltransferase 1 (LPCAT1) correlates to the progression of prostate cancer. Exp Mol Pathol, 2012. 92(1): p. 105-10.
- Shindou, H., et al., Generation of membrane diversity by lysophospholipid acyltransferases. J Biochem, 2013. 154(1): p. 21-8.










