ホットトピックス
メタボリックシンドロームと非アルコール性脂肪肝炎(NASH)
小川佳宏
東京医科歯科大学大学院医歯学総合研究科分子内分泌代謝学分野
東京医科歯科大学医学部附属病院糖尿病・内分泌・代謝内科
メタボリックシンドロームの概念は、内臓脂肪型肥満を背景として耐糖能異常、脂質異常症、血圧上昇などの病態が並行して進展し、糖尿病、高血圧症、慢性腎臓病、動脈硬化症などの生活習慣病を発症するという流れを指摘したものである。生活習慣病は過栄養や運動不足による代謝ストレスに対する適応の破綻部より発症すると考えられるが、生活習慣病を中心とする非感染性疾患(NCDs: Non-Communicable Diseases)における病態には不明点が多い。一方、エネルギー代謝障害を基盤とする生活習慣病の発症時期は微生物感染のように明確ではなく、臨床症状が顕性化するまで年余の時間を要することも稀ではないため、近年、精度の高い発症予測あるいは正確な発症前診断に基づいて積極的な介入を試みる「先制医療」の概念が注目されている。
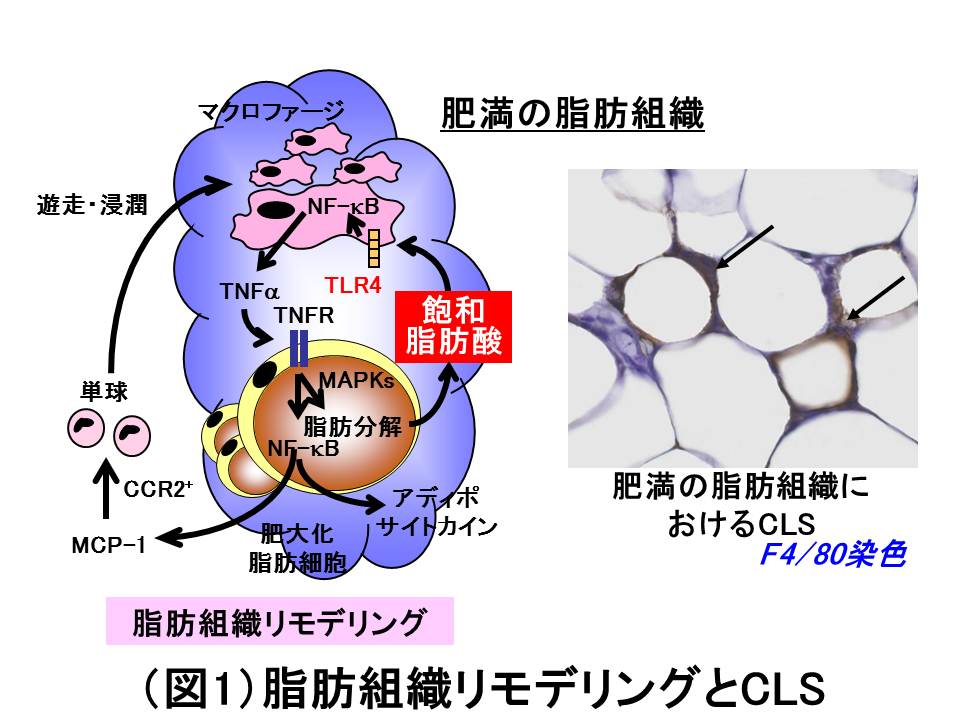
肥満の脂肪組織では、脂肪の過剰蓄積による脂肪細胞の肥大化のみならず血管新生、炎症細胞の浸潤、間質の線維化、アディポカイン産生調節の破綻などのダイナミックな変化が認められる。この一連の変化は動脈硬化における血管壁リモデリングと酷似しており、「脂肪組織リモデリング」と呼ばれている。我々は既に、肥満の脂肪組織では脂肪分解により放出される飽和脂肪酸が病原体センサーであるTLR4(Toll-like receptor 4)を介して間質に浸潤するマクロファージを活性化すること、活性化されたマクロファージではTNFαの産生が亢進し、これが脂肪細胞において炎症反応を増悪・慢性化することを世界に先駆けて報告した(図1)。形態学的には、脂肪の過剰蓄積により肥大化して細胞死に陥った脂肪細胞をマクロファージが取り囲んで処理するユニークな構造物(crown-like structures(CLS):王冠様構造)が認められる(図1)。このCLSは脂肪細胞とマクロファージの相互作用の場として脂肪組織リモデリングに関連すると考えられている。
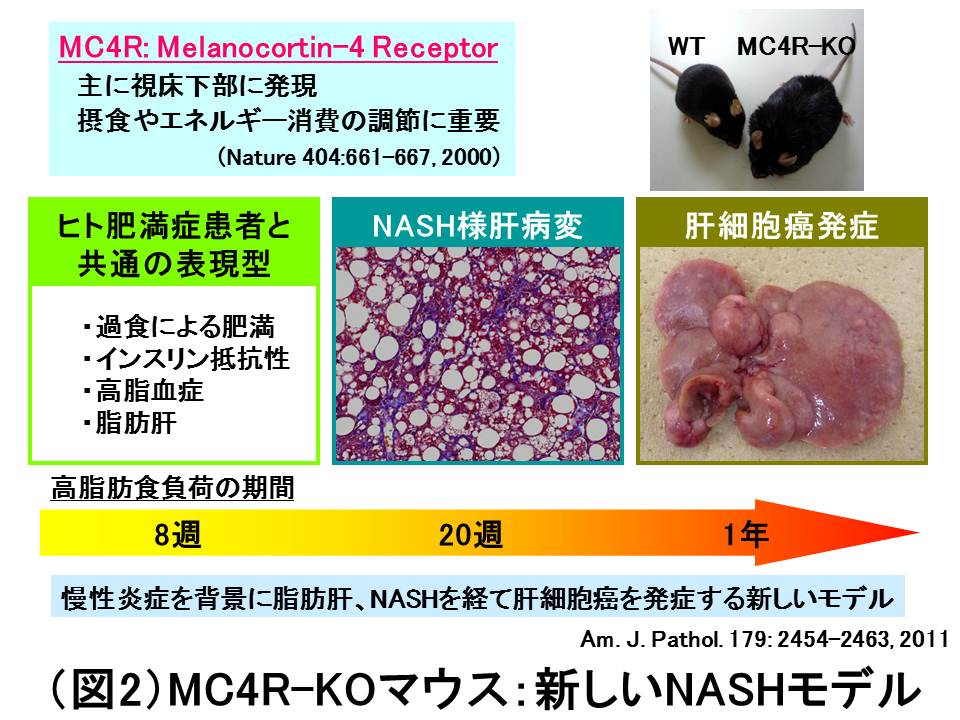
アルコール多飲歴がないにもかかわらず発症する非アルコール性脂肪性肝疾患(NAFLD: nonalcoholic fatty liver disease)は、内臓脂肪型肥満、糖尿病、脂質異常症、インスリン抵抗性と深く関連するため、メタボリックシンドロームの肝臓における表現型と考えられている。NAFLDのうち肝実質細胞の壊死や炎症所見を伴う非アルコール性脂肪肝炎(NASH: nonalcoholic steatohepatitis)は進行性の慢性肝疾患であり、高い頻度で肝硬変から肝臓癌を発症するために治療介入が必要である。しかしながら、NASHの確定診断には肝生検組織診断が必須であり、メタボリックシンドロームから脂肪肝、NASHを経て肝硬変、肝臓癌を発症する経時変化には不明な点が多い。従来、特殊な飼料や薬剤により誘導した肝線維化モデルが多数報告されているが、これらの多くは代謝障害を伴わず、ヒトNASHの炎症所見や線維化の組織像とは明らかに異なっている。このため、どのようにして単純性脂肪肝から炎症所見や線維化を呈するNASHに進展するのか不明であった。我々は最近、中枢性摂食調節に関与するメラノコルチン4型受容体(MC4R: melanocortin receptor 4)を欠損するマウスを用いてヒトNASHの病態に酷似した疾患モデルマウスの開発に成功した(図2)。このマウスでは、肥満に伴って脂肪組織における炎症が慢性化して過剰に放出される遊離脂肪酸が肝臓に蓄積されて「異所性脂肪」として肝病変が進展すると考えられる(Am. J. Pathol. 179: 2454-2463, 2011)。
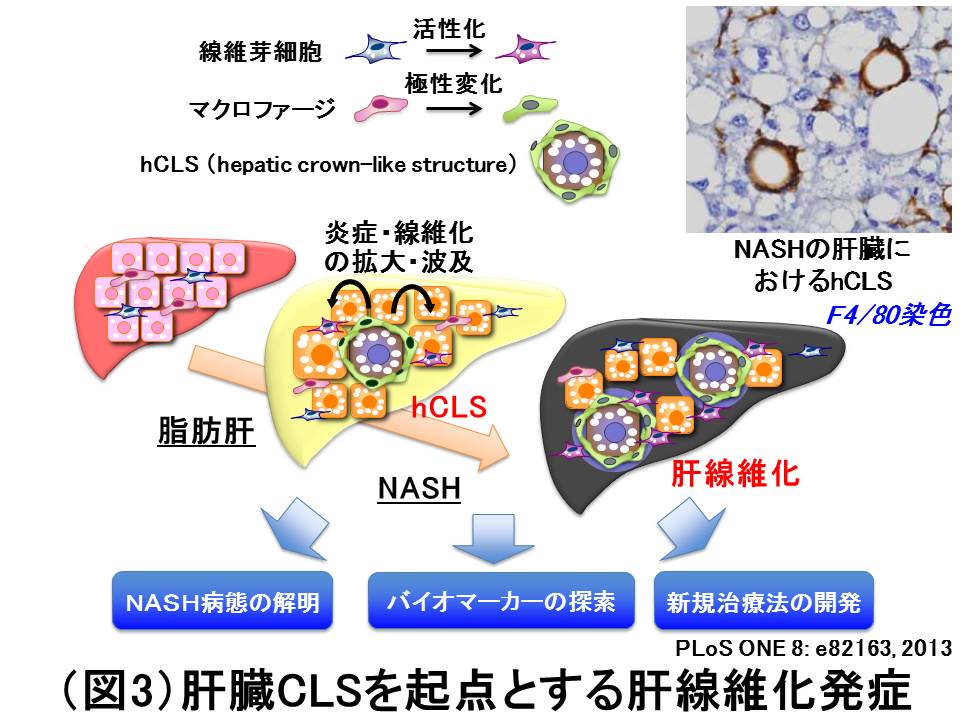
NASH様病変を呈する肝臓では、肥満の脂肪組織において認められるCLSと類似した組織学的特徴として、過剰な脂肪蓄積により細胞死に陥った肝実質細胞をマクロファージが取り囲んで貪食・処理する構造が認められる(hepatic CLS(hCLS))。hCLSは肝線維化に先行して認められ、周囲に肝線維化を誘導する活性化線維芽細胞の集積やコラーゲン線維の沈着が認められる(図3)。実際に、hCLSの個数は肝臓の線維化面積と比例し、NASHの重症度を反映すると考えられる。更に、hCLSを構成するマクロファージは、他のマクロファージと表面マーカーや性質が異なることが明らかになっている。又、同程度に肝障害が生じている慢性ウイルス性肝炎症例ではhCLSはほとんど認められない。以上より、hCLSが慢性炎症と線維化の起点になって脂肪肝からNASHに進展する可能性が示唆される(図3)(PLoS ONE 8: e82163, 2013)。
メタボリックシンドロームから多彩な生活習慣病が顕在化する過程では、細胞間相互作用により脂肪組織局所において誘導される炎症の慢性化が契機となり、複雑かつ巧妙な臓器代謝ネットワークの破綻により全身の遠隔臓器に波及・拡大化すると考えられる。肥満の脂肪組織とNASHの肝臓のいずれにおいても実質細胞と間質細胞の相互作用により炎症反応が開始・慢性化され、その結果、臓器の機能不全がもたらされると考えられる。生体防御反応としての炎症は、多くの慢性疾患の発症前段階あるいは初期段階にも認められるため、生活習慣病の先制医療の恰好のターゲットになりうる。
【参考文献】
- Y. Iwasaki et al. Activating transcription factor 4 links metabolic stress to interleukin-6 expression in macrophages. Diabetes 63: 152-161, 2014.
- M. Itoh et al. Hepatic crown-like structure: a unique histological feature in non-alcoholic steatohepatitis in mice and humans. PLoS ONE 8: e82163, 2013.
- M. Itoh et al. Melanocortin-4 receptor-deficient mice as a novel mouse model of non-alcoholic steatohepatitis. Am. J. Pathol. 179: 2454-2463, 2011.
- T. Suganami et al. Role of the Toll-like receptor 4/NF-κB pathway in saturated fatty acid-induced inflammatory changes in the interaction between adipocytes and macrophages. Arterioscler. Thromb. Vasc. Biol. 27: 84-91, 2007.
- T. Suganami et al. A paracrine loop between adipocytes and macrophages aggravates inflammatory changes: role of free fatty acids and tumor necrosis factor α. Arterioscler. Thromb. Vasc. Biol. 25: 2062-2068, 2005.
- 小川佳宏編「疾患発症のニッチに潜む慢性炎症の分子プロセス-組織リモデリングから自然炎症の概念まで-」実験医学(Vol.28 No.11 2010)羊土社
- 小川佳宏「日本人だから知っておきたい異所性脂肪の恐怖」 2012 ワニブックス