ホットトピックス
肝発生における転写制御とヒト幹細胞からの分化誘導
長岡 正人
福井大学テニュアトラック推進本部
はじめに
ヒトES細胞やiPS細胞から分化誘導した肝細胞は、薬物代謝研究やMODY (Maturity onset diabetes of the young)などの遺伝子疾患の治療法の探索など様々な応用が期待されており、世界中の多くの研究者によって最適な誘導法が研究されている。本稿では、肝発生時における転写因子の発現変化と、ヒト幹細胞由来肝細胞の分化誘導法についてまとめたい。
マウス肝発生過程での転写因子の発現変動
マウスの肝発生時に発現する転写因子については総説によくまとめられており、各段階で必須な転写因子の発現パターンが明らかになりつつある1,2。まずは、簡単に概略をまとめたい(図1A)。肝細胞を含む内胚葉系の細胞に分化する胚体内胚葉(definitive endoderm)は、中胚葉にも分化する共通の前駆細胞である中内胚葉(mesendoderm)細胞に由来し、周囲の間葉系細胞が分泌するBMPやFGFによって肝前駆細胞への分化が誘導されると考えられている。この過程で、胚体内胚葉細胞ではFoxAとGATAの発現が亢進し、これらの転写因子が協奏的に働く事で、肝細胞に特異的なタンパク質(アルブミンなど)の転写が誘導される事が報告されている3。FoxAファクターを欠損した胚では肝特異的な遺伝子の発現が誘導されず、またFoxAを欠損した胚体内胚葉に対してin vitroでFGFを添加しても肝特異的遺伝子の発現が誘導されない事から、FoxAファクターは肝細胞への分化誘導に必須である事がわかる4。また、HNF1βはFoxA1とFoxA2の発現を誘導する事が報告されており5、 FoxA、GATA、HNF1βが胚体内胚葉から肝前駆細胞への分化に必須であると考えられる。その後、BMPと FGFの刺激により、GATA4を介したHexの発現が誘導され、さらにProx1、Tbx3、Hnf6の発現が誘導される。Hex、Prox1、Tbx3、HNF6は前駆細胞の増殖と横中隔(septum transversum)への浸潤を促進し、この過程でmatrix metalloproteinase(MMP)の発現が誘導される。分化した前駆細胞では、肝細胞への分化に必須な転写因子として知られるHnf4aの発現が増強され6-8、その後周囲の間充織細胞から分泌されるHGF、BMP、FGF、Wnt、TGFβやレチノイン酸の刺激により、肝芽細胞へと分化する。肝芽細胞は、肝実質細胞と胆管細胞の両方に分化できるが、C/EBPαやHNF6、OC-2などの転写因子の発現バランスが肝芽細胞から肝実質細胞と胆管細胞への運命決定に重要である事が示されている(図1A)。
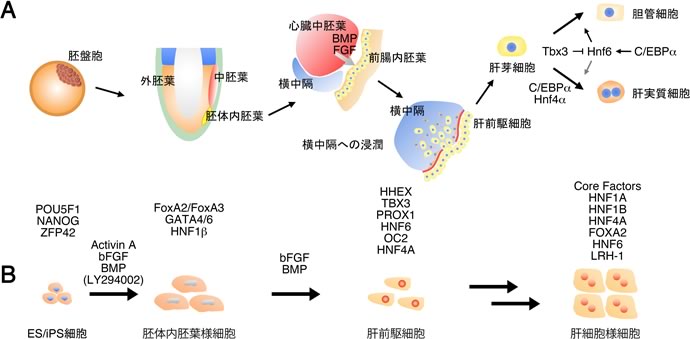
図1 マウス肝発生(A)とヒト幹細胞からの分化誘導(B)。
マウスの発生過程では、胚体内胚葉から分化した前腸内胚葉が心臓中胚葉からのBMP、FGF刺激により肝前駆細胞へと分化し、横中隔への浸潤を開始する。その後、さらに分化した肝芽細胞から肝実質細胞と胆管細胞へと分化する。ヒト幹細胞から肝細胞様細胞への分化誘導は、マウスの発生過程を模しており、分化過程の転写因子の発現パターンはマウスのものとほぼ一致している。
ヒトES/iPS細胞の分化誘導と転写因子の役割
ヒトES/iPS細胞からの分化誘導系の多くはマウスの発生過程を元にして増殖因子を添加しており、私が先日まで所属していたProf. DuncanのラボでもヒトES細胞およびiPS細胞から肝細胞への分化誘導とその過程での転写因子の発現変動の解析を行っている9,10。その結果から転写因子の発現パターンもマウスの発生過程の発現変動と非常によく相関している事がわかる(図1B)。分化誘導初期の胚体内胚葉の段階では、FOXA2、GATA4、GATA6の発現が強く誘導され、さらに前駆細胞への分化過程ではHHEX、TBX3、HNF4Aの発現が増強する。HNF4Aは、肝細胞の分化および成熟化に必須な転写因子の一つと考えられているが、HNF4Aに対するshRNAを発現させたヒトES細胞でも、胚体内胚葉へはHNF4Aの発現を抑制していない細胞と変わらず分化するが、その後の分化が進まずHHEXやTBX3の発現が消失する10。興味深い事に、胚体内胚葉のマーカーであるFOXA2やGATA4、GATA6についても発現が消失しており、また細胞増殖や細胞死の割合に変化がない事から、胚体内胚葉から他の種類の細胞に分化している可能性が考えられる。現在、HNF4A以外の転写因子についてもノックダウンによる効果の研究が進められており、それぞれの転写因子が肝細胞の分化過程で果たす役割が解明される事が期待される。
ヒトES/iPS細胞から分化誘導した肝細胞様細胞は、多くの場合実際の肝細胞に比べて特異的な遺伝子発現が極端に低い事が問題とされている。その解決策として強制発現による転写因子の発現増強が試みられており、一定の効果が報告されている11-13。しかし、それでも生体由来の細胞と比較すると肝特異的遺伝子群の発現量は低く、その原因として転写因子の発現バランスが最適化されていない事が考えられる。例えばマウスの発生過程では、HNF6の発現レベルが多くても少なくても肝芽細胞から肝実質細胞への分化には不利である事が知られており、他の転写因子についても発現するバランスが重要である事が示唆されている。そのため、誘導型発現系を用いる事で、ターゲットとする転写因子の発現の量と時間を制御する事、または細胞を取り巻く環境の整備によって転写因子の発現バランスを生体の細胞でのバランスに近づける事で、改善できる事が期待される。
転写因子の発現を誘導するシグナルの多くは増殖因子やシグナル伝達の阻害剤の添加、あるいは分化過程で細胞自身が分泌する液性因子などによって活性化される。未分化な状態から胚体内胚葉への分化には通常Activin Aが用いられるが、BMPやFGFを添加する事で、FOXA2やGATA4を発現する細胞の割合が増加する事が知られている。この過程で重要なシグナル伝達系はMAPKシグナルとPI3K-Aktシグナルであり、MAPKシグナル伝達系を阻害する事で分化は完全に抑制され、PI3Kシグナルを抑制すると分化が促進される事が報告されている。また、分化の初期の過程でBMPとFGFをActivin Aと一緒に添加した場合、HNF4Aの発現が誘導される場合がある事を私たちは確認しているが、HNF4Aは肝前駆細胞だけではなく原始内胚葉でも発現している事から、分化初期のHNF4Aの発現は胚体内胚葉ではなく原始内胚葉へ分化した細胞の存在あるいは胚体内胚葉への分化の促進の両方が考えられ、今後の検討が必要である。肝芽細胞の成熟化に必須なHNF4Aの発現はMAPKシグナルの活性化によって抑制される事が報告されており14,15、分化の各段階でシグナルの種類と量をコントロールする事が重要である。分化の過程で添加する増殖因子の種類についての検討は広く行われているが、それぞれの増殖因子によって誘起されるシグナルがどのように分化に関わっているかはまだ明らかにされていない。そのため、各増殖因子により活性化されるシグナル伝達系と肝特異的転写因子の発現を制御するシステムを解明する事で、分化の効率を改善できる事が期待できる。
おわりに
ヒトES/iPS細胞から肝細胞を誘導する研究は世界的に見ても競争が激しく、研究の重要性も非常に高いと思われる。しかし、完全に成熟化した肝細胞をin vitroで作成する事は、現在でも非常に困難である。これまで、我が国ではヒトES細胞を用いた研究は倫理面への配慮から非常に限られていたが、iPS細胞の開発により、様々な分野の研究者が参画しやすくなり、領域を越えた研究によって問題点が解決されていく事が期待される。最後に、本稿を書く機会を与えていただきました塩尻信義先生に、この場を借りまして厚くお礼申し上げます。
文献
- Lemaigre, F. P. Mechanisms of liver development: concepts for understanding liver disorders and design of novel therapies. Gastroenterology 137, 62–79 (2009).
- Si-Tayeb, K., Lemaigre, F. P. & Duncan, S. A. Organogenesis and development of the liver. Dev Cell 18, 175–189 (2010).
- Cirillo, L. A. et al. Opening of compacted chromatin by early developmental transcription factors HNF3 (FoxA) and GATA-4. Mol Cell 9, 279–289 (2002).
- Lee, C. S., Friedman, J. R., Fulmer, J. T. & Kaestner, K. H. The initiation of liver development is dependent on Foxa transcription factors. Nature 435, 944–947 (2005).
- Lokmane, L. et al. Crucial role of vHNF1 in vertebrate hepatic specification. Development 135, 2777–2786 (2008).
- Li, J., Ning, G. & Duncan, S. A. Mammalian hepatocyte differentiation requires the transcription factor HNF-4alpha. Genes Dev 14, 464–474 (2000).
- Parviz, F. et al. Hepatocyte nuclear factor 4alpha controls the development of a hepatic epithelium and liver morphogenesis. Nat Genet 34, 292–296 (2003).
- Battle, M. A. et al. Hepatocyte nuclear factor 4alpha orchestrates expression of cell adhesion proteins during the epithelial transformation of the developing liver. PNAS 103, 8419–8424 (2006).
- Si-Tayeb, K. et al. Highly efficient generation of human hepatocyte-like cells from induced pluripotent stem cells. Hepatology 51, 297–305 (2010).
- Delaforest, A. et al. HNF4A is essential for specification of hepatic progenitors from human pluripotent stem cells. Development 188, 4143–4153 (2011).
- Takayama, K. et al. Generation of metabolically functioning hepatocytes from human pluripotent stem cells by FOXA2 and HNF1α transduction. J Hepatol 57, 628–636 (2012).
- Takayama, K. et al. Efficient generation of functional hepatocytes from human embryonic stem cells and induced pluripotent stem cells by HNF4α transduction. Molecular therapy : the journal of the American Society of Gene Therapy 20, 127–137 (2012).
- Inamura, M. et al. Efficient Generation of Hepatoblasts From Human ES Cells and iPS Cells by Transient Overexpression of Homeobox Gene HEX. Molecular therapy : the journal of the American Society of Gene Therapy (2010).doi:10.1038/mt.2010.241
- Hatzis, P., Kyrmizi, I. & Talianidis, I. Mitogen-activated protein kinase-mediated disruption of enhancer-promoter communication inhibits hepatocyte nuclear factor 4alpha expression. Mol Cell Biol 26, 7017–7029 (2006).
- Takagi, S. et al. MicroRNAs regulate human hepatocyte nuclear factor 4alpha, modulating the expression of metabolic enzymes and cell cycle. J Biol Chem 285, 4415–4422 (2010).










