ホットトピックス
C型慢性肝炎に対するペグインターフェロンとリバビリンの治療効果を規定するIL28Bの一塩基多型
宇都浩文、馬渡誠一
鹿児島大学大学院医歯学総合研究科消化器疾患・生活習慣病学
はじめに
C型慢性肝炎の標準治療として、ペグインターフェロン(PEG-IFN)とリバビリン(RBV)の併用療法が行われるようになり、「難治例」と言われていた1型高ウイルス量のC型慢性肝炎患者に対する抗ウイルス効果は、48週間治療でウイルス持続陰性化(sustained viral response; SVR)率が約50%となった。また、最近のC型慢性肝炎治療のガイドラインでは、ウイルスの消失時期により投与期間を48週から72週へ延長させることが推奨され、治療効果はさらに向上してきている。
治療効果を規定する因子としては、大きく分けて宿主因子、ウイルス側因子、薬剤因子が挙げられる(表1)。宿主因子としては、年齢や性別がSVRに寄与する因子として以前から知られていたが、2009年にはIL28B遺伝子近傍に、C型慢性肝炎の治療効果に強く関係する一塩基多型(single nucleotide polymorphism; SNP)が新しく同定された1)2)3)。今回は、C型慢性肝炎に対するPEG-IFNとRBVの併用療法の治療効果を規定するIL28BのSNPについて紹介する。
表1.C型慢性肝炎の治療効果に関わる因子
| 宿主因子 | ウイルス側因子 | 薬剤因子 |
|---|---|---|
| 年齢 | ウイルス量 | IFNの種類 |
| 性 | Genotype | IFNの投与量 |
| 肝線維化の程度 | コアアミノ酸変異(aa70、aa91) | IFNの投与期間 |
| 肝脂肪化 | ISDR変異 | RBVの投与量 |
| インスリン抵抗性 | 併用薬剤 | |
| IL28B 一塩基多型 |
IL28B遺伝子多型とPEG-IFN/RBV併用療法の治療効果の関連
Tanakaら1)は、PEG-IFN/RBV併用療法有効例と無効例の2群を対象として、ヒト遺伝子の約90万か所のSNPを分析し、19番染色体のIL28B遺伝子近傍に、治療無効に強く関連するSNPを同定した。すなわち、IL28B遺伝子座の代表的なSNPであるrs8099917(TT/TG/GG)のマイナーアリル(TGもしくはGG)を持つ患者群は、メジャーアリル (TT) をもつ群に比べ、有意にPEG-IFN/RBV併用療法が無効であることを報告した(P値=2.68×10-32)。さらに、IL28B SNP、年齢、性別、治療歴、血小板数、ALT値、肝線維化、ウイルス量を変数として多変量解析を行うと、IL28B SNP(OR 37.68、95%CI 16.71-83.85、p<0.0001)と女性(OR3.32、95%CI 1.49-7.39、P=0.003)が、治療無効に関連する独立した危険因子であった。
IL28B遺伝子多型に関しては、同様の報告が同じ時期に欧米からも報告された。Suppiahら2)はオーストラリア、ドイツ、イギリス、イタリアでも、同じIL28B SNP(rs8099917SNP)がPEG-IFN/RBVの治療効果に関わると報告し、Geら3)は、白人871人、黒人191人、ヒスパニック75人で検討し、IL28B遺伝子から3kb上流のSNP(rs12979860)がSVRに強く関連することを報告した(P=1.37×10-28)(図1)。また、rs12979860のメジャーアリル(CC)の頻度は東アジア人で最も多く、次に白人とヒスパニックが多く、黒人で最も頻度が低いことが明らかとなり、この頻度とPEG-IFN/RBV併用治療のSVR率が正の相関を示すと報告された(図2)3)。
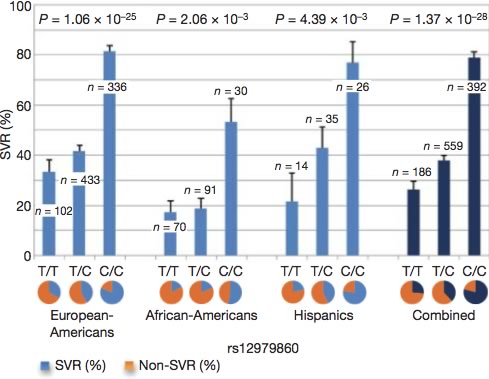
図1.人種別、IL28B一塩基多型(rs12979860)別の著効率(文献3より許可を得て引用)
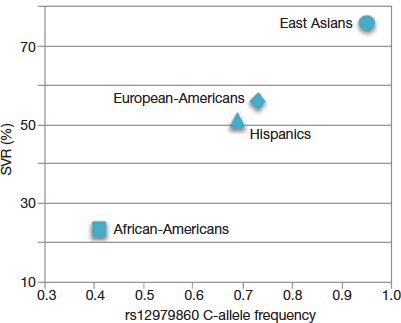
図2.人種別のrs12979860メジャーアリル頻度と著効率の相関(文献3より許可を得て引用)
IL28B遺伝子多型とC型肝炎の病態との関連
Thompsonら4)は、rs12979860のメジャーアリル(CC)群は、マイナーアリル群に比べ、PEG-IFN/RBV併用治療によるウイルス減少が速やかであると報告している。さらに、Thomasら5)は、rs12979860のメジャーアリル群(CC)は、マイナーアリル群(CT/TT)に比べ、C型肝炎ウイルス感染後の自然消失率が約3倍高率であったと報告している。このように、IL28B遺伝子近傍のSNPは、PEG-IFN+RBV療法の治療効果に加えて、HCV感染に対する自然免疫にも深くかかわることが示唆されている。また、IL28B SNPのメジャーアリル群は、マイナーアリル群と比較し、γGTPが低く、組織学的に炎症、線維化、脂肪化の程度が軽度であることが報告されており6)7)、IL28B SNPは治療効果だけでなく、C型肝炎の病態の進行にも関わっていると考えられる。
PEG-IFN/RBV併用療法の治療効果におけるウイルス因子と宿主因子
IFN治療効果を規定するウイルス側因子として、HCV RNAコアアミノ酸変異8)、ISDR(Interferon sensitivity determining region)変異9)がすでに報告されていた(表1)。これらウイルス側因子に宿主因子を加味した多変量解析では、IFN治療無効に関わる因子として、血小板数が少なく、肝線維化が高度(F3-4)、HCV RNA量が多く、IL28B SNPがマイナーアリルであることが挙げられ、逆に、著効に関わる因子として、血小板数が多く、肝線維化が軽度(F0-1)、ISDR変異が2以上、IL28B SNPがメジャーアリルであることも明らかにされている6)。
IL28Bの機能
IL28BはIFNλファミリーに属するサイトカインで、IFNλ3と呼ばれる。19番染色体(19q13)に存在し、IL28A(IFNλ2)、IL29(IFNλ1)と近接している10)。これら3つのIFNλは末梢血単核球や樹状細胞から主に産生される10)。また、IFNλはIFNαとは異なる部位で結合し、シグナル伝達する (図3) 11)。すなわち、IFNλはIFNλレセプター1(R1)とIL10レセプター2(R2)の複合体に結合すると、細胞質内でJanus kinase (JAK)1、tyrosine kinase(TYK)2を介してSTAT1/STAT2を活性化し、IFN刺激遺伝子(Interferon-stimulated gene;ISG)発現を促進することで、抗ウイルス活性を誘導すると考えられている11)。
IL28B SNPのマイナーアリル群ではメジャーアリル群と比較し、末梢血中のIL28Bの発現が低下していることが示されているが1)2)、最近の研究では、マイナーアリル群ではメジャーアリル群と比較し、肝でのISGの発現レベルがむしろ高いことが示されている12)。ISGの発現レベルが肝と末梢血で異なり、投与されたIFNへの反応を制御する機構がHCV感染肝細胞で働いていることが示唆されている10)が、詳細は不明であり、機序の解明が待たれる。
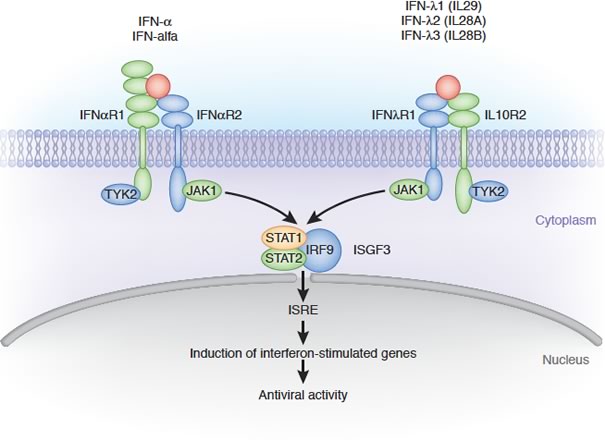
図3.IL28Bを含むインターフェロンのシグナル伝達経路(文献11より許可を得て引用)
おわりに
C型慢性肝炎の治療は最近の10年間で大きく進歩したが、今後、IL28B SNPを含めた宿主因子およびウイルス側因子の詳細な解析により、IFN治療前効果予測の精度が向上し、テーラーメード治療の確立が期待されている。さらに、プロテアーゼ阻害薬が治療薬として使用可能となることで、治療効果を規定する薬剤因子の重要性も高くなると予想される。PEG-IFN+RBV+Telaprevir(プロテアーゼ阻害薬の一つ)の併用療法では、著効率が61%と向上し、IL28B SNPがメジャーアリルの患者では、コアアミノ酸変異に関係なく著効率は84%である13)。また、IL28B SNPがマイナーアリルでも70番のコアアミノ酸がアルギニン(野生型)であれば、著効率は50%であったと報告されている13)。難治といわれた1型高ウイルス量の治療成績が今後さらに向上することが期待でき、治療効果予測におけるIL28B SNPなどの宿主因子やウイルス因子、薬剤因子の意義も変わる可能性がある。
参考文献
- Tanaka Y, et al:Genome-wide association of IL28B with response to pegylated interferon-alpha and ribavirin therapy for chronic hepatitis C. Nat Genet.41; 1105-9, 2009
- Suppiah V, et al:IL28B is associated with response to chronic hepatitis C interferon-alpha and ribavirin therapy. Nat Genet. 41; 1100-4, 2009
- Ge D, et al:Genetic variation in IL28B predicts hepatitis C treatment-induced viral clearance. Nature.461; 399-401, 2009
- Thompson AJ, et al:Interleukin-28B polymorphism improves viral kinetics and is the strongest pretreatment predictor of sustained virologic response in genotype 1 hepatitis C virus.Gastroenterology. 139; 120-9, 2010
- Thomas DL, et al:Genetic variation in IL28B and spontaneous clearance of hepatitis C virus. Nature. 461; 798-801, 2009
- Kurosaki M, et al:Pre-treatment prediction of response to pegylated-interferon plus ribavirin for chronic hepatitis C using genetic polymorphism in IL28B and viral factors. J Hepatol. 54; 439-448, 2011
- Abe H, et al:Common variation of IL28 affects gamma-GTP levels and inflammation of the liver in chronically infected hepatitis C virus patients. J Hepatol. 53; 439-43, 2010
- Akuta N, et al:Association of amino acid substitution pattern in core protein of hepatitis C virus genotype 1b high viral load and non-virological response to interferon-ribavirin combination therapy. Intervirology. 48; 372-80,2005
- Enomoto N, et al: Mutations in the nonstructural protein 5A gene and response to interferon in patients with chronic hepatitis C virus 1b infection. N Engl J Med. 334: 77-81,1996
- Ahlenstiel G, et al:IL28B in hepatitis C virus infection: translating pharmacogenomics into clinical practice. J Gastroenterol.45; 903-10, 2010
- O'Brien TR:Interferon-alfa, interferon-lambda and hepatitis C. Nat Genet. 41;1048-50, 2009
- Honda M, et al:Hepatic ISG expression is associated with genetic variation in interleukin 28B and the outcome of IFN therapy for chronic hepatitis C.Gastroenterology.139; 499-509, 2010
- Akuta N, et al:Amino acid substitution in hepatitis C virus core region and genetic variation near the interleukin 28B gene predict viral response to telaprevir with peginterferon and ribavirin.Hepatology. 52; 421-9, 2010










