ホットトピックス
光プローブによる肝ストレス・イメージング
尾崎倫孝
北海道大学医学部 大学院医学研究科 分子制御外科学講座 教授
E-mail: ozaki-m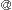 med.hokudai.ac.jp
med.hokudai.ac.jp
病変の質的診断は、外科診断・治療において手術療法、化学療法の適応、選択、方法を考える上で非常に重要であるにもかかわらず、生体内におけるそれら臓器の状態、病変の特性を直接明らかにする試みはその端緒についたばかりである。
ところで、肝臓におけるストレスは種々の環境的要因、(生理的あるいは病的)内的要因により引き起こされる。特殊な環境下でのストレスのみならず、現代社会では日常生活においても慢性的にストレスがかかっている。これまでの動物実験等の結果から、精神的あるいは肉体的・物理的なストレスが、実際に肝の障害を引き起こすことは知られているが、その詳細は不明である。「静かな臓器」である肝は、ストレスに関してもかなり寛容であると考えられるが、肝に対する種々の急性・慢性ストレスに起因して多くの身体の障害を引き起こす(図1)。
我々は、主として外科的治療が肝臓へ与えるストレス、糖尿病・脂肪肝・加齢など種々の状態下にある肝の外科的ストレスに対する反応性の変化を従来の分子生物学的な手法および光プローブを用いた生体イメージングの手法による解析を試みている。慢性ストレス下にある肝臓に対する外科的ストレス(肝切除、虚血など)への応答の変化を観察することにより、肝の周囲環境への適応・反応の限界を研究するとともに、ストレスに対する肝の持つ許容能・限界を理解し、生体イメージングによる新たな診断法、治療法の開発を試みている1)。
こういった目的を達成するための新しい解析手法として、蛍光・発光を利用した新たな分子プローブを開発し、細胞・組織環境あるいは分子機能を可視化することが出来れば、生体へのストレス、応答性を理解すること、あるいは同一個体において非侵襲的かつ継続的に生体の機能(状態)をモニタリングすることが可能となる。
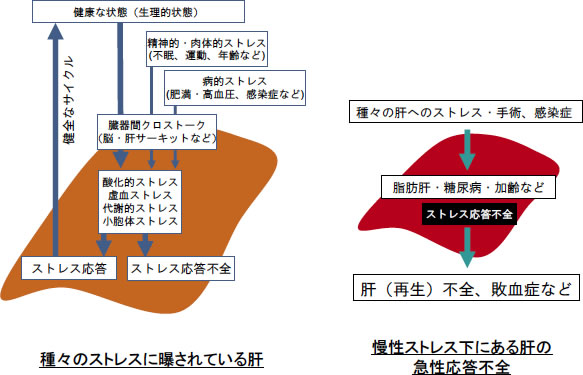
図1: 慢性ストレスおよび急性(外科)ストレスに対する肝の応答(文献1より改変)
1) 酸化的ストレスを可視化するためのレドックス感受性GFP 蛍光プローブ
外科手術時にかかる臓器へのストレスを軽減することは非常に重要であり、手術時に臓器にかかる「ストレスを診る」ことが可能であれば、術後に生じる臓器傷害を予測することも可能かもしれない。肝臓の手術(肝切除および肝移植)において遭遇する「肝臓の虚血・再灌流」あるいは「肝切除」における酸化ストレスを評価する目的で、レドックス感受性を持つGFPを利用した生体イメージングを試みている2)。臨床における肝臓切除および臓器移植では、一時的な虚血とそれに引き続く血液の再灌流(再酸素化)が不可避であるが、それに伴った重要なストレスのひとつが酸化ストレスである 3、4)。このストレスを生体レベルで非侵襲的・経時的に可視化出来れば、切除後・移植後の臓器の酸化・還元状態をリアルタイムに把握できる。これを低酸素・再酸素化した細胞に応用し、細胞内レドックスの変化を経時的にモニターした(図2)。また、アデノウィルスベクターにて、マウス肝に特異的に遺伝子導入し、肝虚血・再灌流モデルを作成した。虚血前・中および再灌流後の肝のレドックス状態をイメージングし、レドックスの変化とその後の臓器傷害の程度を検討した。過度の虚血では、再灌流後にも酸化ストレスは起こらずそのまま壊死状態となったが、再灌流直後の酸化ストレスは肝の虚血時間に応じて強くなり、術後傷害に関連していた。虚血・再灌流直後の肝レドックス状態がその後に起こる傷害を予測するマーカーとなりうると考えられた(図3)5)。
GFPをベースにしたプローブは、紫外線照射が必要であり、励起される波長も比較的短いために生体内での臓器機能評価は困難である。生体内深部の微細な変化をとらえるために、我々は「発光系」によるプローブを同時に開発している。
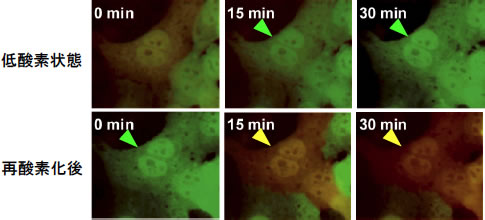
図2: 低酸素・再酸素化によるAML12肝細胞のレドックスの変化(文献4より改変)
低酸素中の相対的還元状態の細胞(緑色矢印)と再酸素化後の酸化状態の細胞(黄色矢印)を示す。
図3: 虚血時間と再灌流後酸化ストレスとの関係(文献4より改変)
2)細胞へのダメージを可視化するための発光プローブ(ホタル・ルシフェラーゼを利用したカスパーゼ-3活性化プローブ)
ルシフェリン/ルシフェラーゼの化学反応による発光に着目して、生体内用のプローブの作成が試みられている。この化学発光では、比較的長い波長(600nm以上)のシグナルを得ることが可能なために、臓器・生体内の機能評価に適していると考えられる。
カスパーゼ-3はアポトーシスの発現に非常に重要な役割を果たしており、広く研究がなされている。このカスパーゼ-3の活性化を検出するために、インテイン(DnaE)のN末端側ポリペプチドとルシフェラーゼのN末端を結合、およびインテイン(DnaE)のC末端側ポリペプチドとルシフェラーゼのC末端を結合した”環状ルシフェラーゼ”という新たなプローブの概念で、その間にカスパーゼ-3の基質配列(DEVD)を挟み込んだプローブが開発された6)。このプローブは、カスパーゼ-3の基質部位が切断されるとルシフェラーゼが活性化型フォームに戻り、その活性を回復させる(図4)。このプローブを導入したAML12肝細胞株においてFas経路を刺激すると、カスパーゼ-3が活性化され、同時にアポトーシスも誘導された(図5)。さらに、マウスを用いて70%肝虚血/再灌流モデルにおける活性化カスパーゼ-3の生体イメージングを試みた。肝虚血後、再灌流時に肝シグナルが経時的に増強していく様子が観察され、虚血時間とともにシグナルは増強し、かつそのピークも遅延した(図6)。
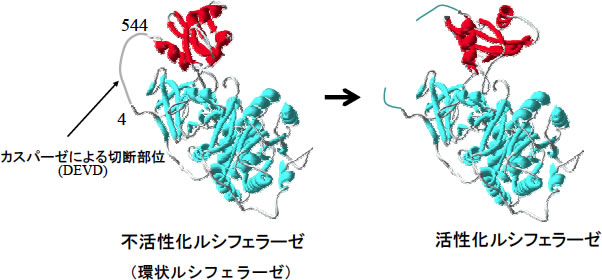
図4: 環状ルシフェラーゼを用いたカスパーゼ-3活性の可視化プローブ(文献1より改変)
赤色:Firefly luciferase (Fluc) C末端側球状ドメイン、水色:Fluc N末端側球状ドメイン
Fluc活性にはドメイン間に4nmの距離を要するが、環状Flucは2nmのリンカーにより閉環され不活化しており、Caspase-3によるリンカー中のDEVD配列の切断により、不活化は解除される。
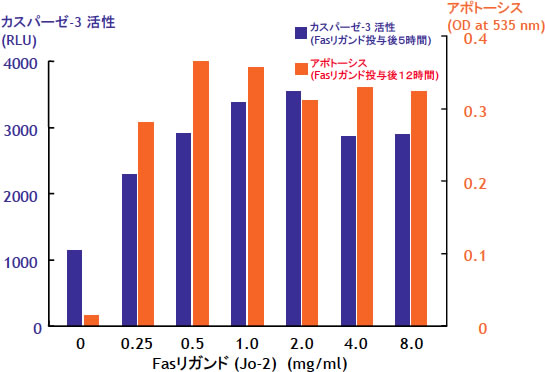
図5: マウス由来肝細胞のFas刺激によるカスパーゼ-3活性化とアポトーシスの関係
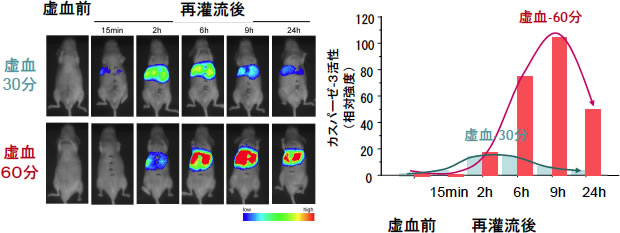
図6: マウス肝虚血・再灌流時の肝傷害イメージング(文献1より改変)
カスパーゼ-3活性により表されている肝傷害は、虚血時間に応じて強くなっている。
3)特異的抗体への光プローブの搭載による新しい診断・治療法の確立(術中診断などを目的として)
我々は確実で効果的な抗体診断・治療法の確立に向けて、抗体に対する光プローブ搭載の研究・検討を行なってきた。図7に示すごとく、このプローブはルシフェラーゼ部分とIndocyanine green (ICG)部分からなり、ビオチン化されている。ルシフェリン投与により得られるシグナルは長波長(~700nm)であり組織通過性が強く深部病変のイメージングに適しており、種々の抗体に搭載することが可能である7)。このプローブを用いることにより、より深部からのシグナルを得ることが可能となり、今後臨床に向けた研究開発が期待される。
種々の病態により、臓器の反応・易傷害性(傷害の程度、タイミング)の違いなども非侵襲的に知り得ることは、将来の臨床診断・治療に大きな変化を与えるものと期待される。これらのプローブは刺激に対する分子のダイナミズムを同一個体で、経時的かつ非侵襲的に捉えることを可能とするが、様々な疾患の機序解析・ストレス応答・創薬といった分野で大いに役立つものと考えている。
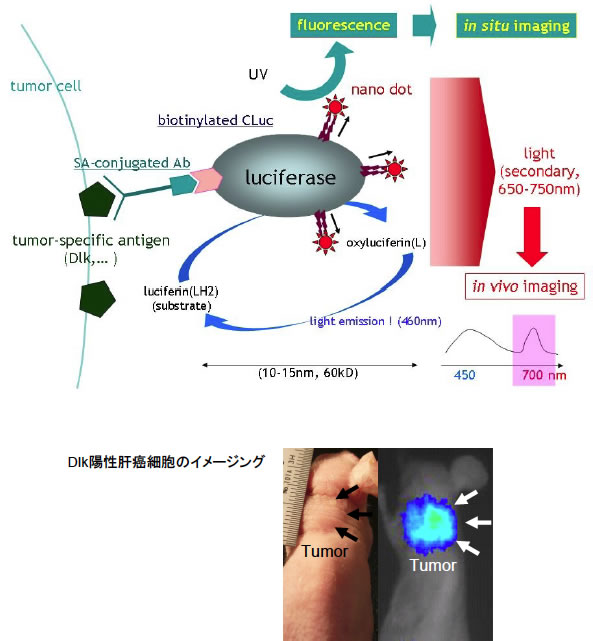
図7: 蛍光・発光を利用した生体プローブのデザイン
| 上: | Luciferin-Luciferase反応による短波長光(460nm)はインドシアニン・グリーン(ICG)を励起し組織透過性の高い長波長光(650-750nm)を発する。 |
| 下: | ヌードマウス後頚部皮下に移植した肝癌細胞表面に発現したDlkを標的抗原とした生体イメージング。 |
References:
- 尾崎倫孝 : Biophilia 5: 38-41, 2009.
- Hanson GT, et al : J Biol Chem 279: 13044–13053, 2004.
- Ozaki M, et al : Cell Death Differ 10: 508-515, 2003.
- Ozaki M, et al : FASEB J 14: 418-429, 2000.
- Haga S, et al : Antioxid & Redox Signal 11: 2563-2572, 2009.
- Kanno A, et al : Angew Chem-Int Edit 46: 7595 –7599, 2007.
- Wu C, et al : Proc Natl Acad Sci USA 106: 15599–15603, 2009.










