ホットトピックス
トランスグルタミナーゼを介する新しい肝細胞死経路
Gastroenterology, 136, 1783-1795 (2009)
小嶋聡一
理化学研究所 基幹研究所 ケミカルバイオロジー領域 分子リガンド生物研究チーム
E-mail: skojima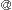 riken.jp
riken.jp
要約
アルコール性脂肪性肝炎の原因である過度のアルコール摂取によって、タンパク質架橋酵素トランスグルタミナーゼが肝細胞の核に移行し、肝細胞の生存に必須の肝細胞増殖因子受容体c-Met遺伝子の発現を司る転写因子Sp1を架橋・不活性化する結果、カスパーゼ非依存の肝細胞死が誘導されることを発見した。
1.アルコール性肝障害
アルコール過剰摂取は全世界で年間200万人の死亡原因となっている。脂肪肝の状態から、肝細胞死、炎症、線維化を伴う肝障害、肝硬変、肝癌と移行する。その分子機構として、活性酸素の上昇や多数のシグナル伝達の変化が報告されているが、肝細胞死の分子機構は不明であった。肝細胞にアルコールを処理すると、タンパク質架橋酵素トランスグルタミナーゼ(TG)活性が上昇することが報告されていたが1)、この酵素がどのように細胞死を引き起こすのかについては分かっていなかった。
2.TG
TGは、タンパク質のGln-Lys残基間に共有結合を形成する翻訳後架橋修飾酵素群である2, 3)(図1A)。ヒトでは9種類のTG遺伝子が同定され、図1Bに示すような性質決定がなされている。このうち、赤血球に存在するバンド4.2は活性発現に必要なCys残基が存在せず、酵素活性を持たない。他のメンバーは、Ca2+結合部位や活性中心部位など一次配列上相同領域を有しているが、それぞれ独自の組織発現パターンを示す。この酵素群が多種多様な基質分子内、分子間で架橋反応を行うことにより、基質タンパクは新しい機能を得て生理的に働いたり、機能を失い病気の原因となっている。Lys残基の代わりに1級アミンがGln残基に架橋されるポリアミン修飾反応や、水分子が反応することによって起こるGln残基の脱アミド反応を通しても様々な生物活性を発現することが知られている2, 3)。例えば、欧米に多いセリアック病は、小麦に含まれる植物性タンパクのグルテンの一分画であるグリアジン由来ペプチドが、十二指腸粘膜下組織内でTG2により脱アミノ化され、抗原となり、自己抗体が産生されることが原因となっている2)。
| 図1 TG2の反応機構と種類 | |
| A, | TG2による2段階架橋反応の様子。基質タンパク質中のグルタミン残基とTG2の間で反応中間体が形成され、これに反応する基質分子(H2O、リシン残基を持つタンパク質、ポリアミン)により反応産物は異なる。 |
| B, | ヒトTGの種類と特徴。 |
古くから細胞死に組織トランスグルタミナーゼ(TG2)が関わっていることが報告されてきた4)。TG2は生体構造の構築や安定化を行う一方、細胞の増殖・分化、アポトーシスに働き、多様な生命現象、さらには動脈硬化、肝疾患、脳神経変性疾患など、様々な病態形成に深く関係している。肝臓では、マロリーデンクボディーの形成への関与が報告されていた5) 。
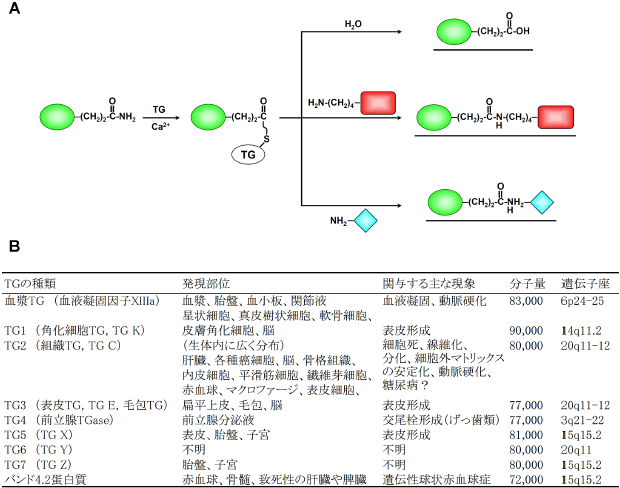
TG2はβサンドウィッチ、コアドメイン(活性部位)、2つのβバレル(樽状)ドメインからなり、活性中心のCys277, His335, Asp358が空間的に近い配置をとり、架橋反応を司る6)(図2A)。TG2は架橋活性以外にもGTPase活性(Gタンパク複合体の構成成分であるGαhとして働く)、タンパク質ジスルフィドイソメラーゼ活性やリン酸化活性、インテグリン細胞接着活性など数多くの活性を有する多機能酵素である。通常の低濃度(10~20 nM)Ca2+存在下ではGTPase活性を示すが、細胞が障害を受けて高濃度(700~800 nM)Ca2+存在下になると、Ca2+がβバレル1に結合することにより立体構造が変化し、βバレル1の一部が外れ、架橋結合活性の活性中心が露出し、架橋酵素として働くようになる(図2B)。
| 図2 TG2の機能部位とCa2+による立体構造変換 | |
| A, | TG2は4つのドメインを持っており、各ドメインに様々な機能部位が存在する。フィブロネクチン結合領域, A2-E7(水色);インテグリン結合領域(N末端から28 kDのフラグメント);細胞外領域に分泌するため必須領域, Y274(緑色);活性中心の触媒領域, Cys277-His335-Asp358(青色);Ca2+結合領域(赤色);GTP結合領域, K173-Y174, R476-S482, R580-Y583(橙色);ホスホリパーゼC(PLC)δ1結合領域, L665-K672(紫色) |
| B, | Ca2+が低濃度(10~20 nM)の時にはTG2はGTPase活性を示す左の立体構造になっているが、Ca2+が高濃度になると立体構造が大きく変化し、GTPase活性領域を隠し、架橋結合活性を示す立体構造に変化する。 |
3.TG2を介した肝細胞死誘導機構
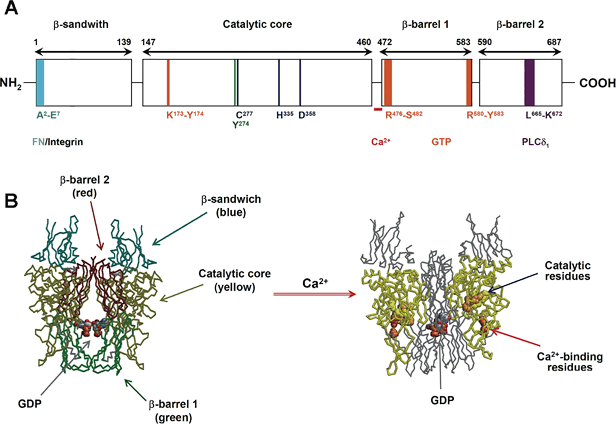
野生型マウスとTG2遺伝子欠損マウスから単離した肝細胞をアルコール処理したところ、野生型の肝細胞では細胞死が誘導されたが、TG2遺伝子欠損マウスでは細胞死が誘導されなかった。アルコール処理により肝細胞において発現が変化する遺伝子を網羅的に調べたところ、肝細胞増殖因子受容体c-Metの発現が顕著に低下していることが分かった。c-Metは肝細胞の生存シグナルに大変重要な役割を担っており7)、その遺伝子発現は転写因子Sp1により調節されている8)。そこで、Sp1がTG2により影響(修飾)を受けるかどうかについて調べたところ、Sp1はTG2の作用で架橋され、高分子量の不活性型Sp1を産生した。この機能を失ったSp1架橋体を特異的に認識する抗体を作製し(特許申請中)、同抗体を用いて、アルコール処理した肝細胞ではTG2の活性上昇や核移行が起こると共に、Sp1架橋体が生成し、Sp1の活性喪失と相関してc-Metの発現が低下し、肝細胞が死に至ることを見出した(図3)9)。この細胞死経路はzDEVDなどのカスパーゼ阻害剤で抑制されないことから、カスパーゼ非依存経路であると考えられる。
図3 転写因子Sp1の架橋・不活性化を伴うアルコールによる肝細胞死(アポトーシス)
アルコールによる肝細胞死は、核に移行した架橋酵素TG2(①)により転写因子Sp1が架橋修飾反応を受け、失活する(②)結果、細胞増殖因子受容体c-Metの発現が低下する(③)ために起こる、という新しい細胞死経路を解明した。写真:野生型およびTG2遺伝子欠損マウスから単離された肝細胞をエタノールで処理した。核染色はヘキスト33258を用いた。矢印の先にアポトーシスを起こした細胞(核が断片化し凝集した様子)が観察される。(スケール50 μm)
4.生体内での検証
劇症肝炎モデルマウスおよびアルコール性脂肪性肝炎モデルマウス(図4左)、アルコール性脂肪性肝炎患者(図4右)の肝組織では、TG2が細胞核に発現し、Sp1架橋体の生成が検出され、TG2阻害剤を投与したマウスや、TG2遺伝子欠損マウスでは、肝障害になりにくいという結果を得た9)。これらの結果は細胞レベルで見られた一連の現象が、生体内でも起こっていることを示唆する結果である。
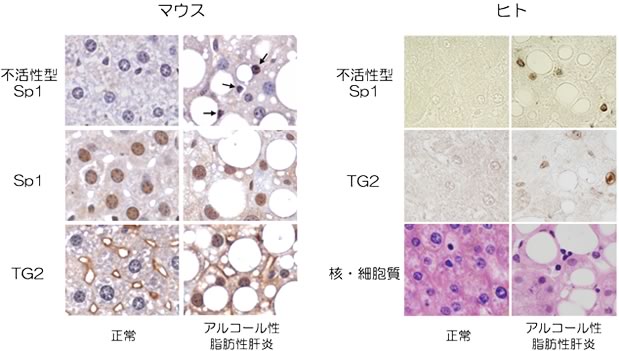
図4 アルコール性脂肪性肝炎のモデルマウスと患者の肝組織
【アルコール性脂肪性肝炎のモデルマウス(左)】
アルコール性脂肪性肝炎に陥ったマウスの肝臓を用いて染色した。細胞核は青色で、それぞれのタンパク質(不活性型Sp1、Sp1、TG2)の量は茶色のシグナルで示した。アルコール性脂肪性肝炎を発症したマウスでは、Sp1総量の変化は見られないが、不活性型Sp1の量は顕著に増加した。また、TG2が核に多量に存在することを検出した。
【アルコール性脂肪性肝炎の患者(右)】
アルコール性脂肪性肝炎の患者の肝臓を用いて染色した。核における不活性型Sp1とTG2の蓄積が観察できた。両肝切片とも厚さ5 μmでスライスした。
さらに、c-Metの減少が肝線維化を招くという報告がGiebelerらからなされ10)、我々の成績と一緒にすると、アルコール性脂肪性肝炎における細胞死と線維化が一つのパスウエイでつながった11)。
今後、今回明らかにした新しい細胞死経路がアルコール肝障害時に起こる肝細胞死以外のどのようなケースで働いているかを明らかにしていく予定である。今回の発見が、肝疾患の新しい診断法、治療・予防法の開発に寄与することを願っている。
参考文献
- Wu, J. et al. : Roles of tissue transglutaminase in ethanol-induced inhibition of hepatocyte proliferation and α1-adrenergic signal transduction. J. Biol. Chem., 275, 22213-22219 (2000)
- Lorand, L. and Graham R.M. : Transglutaminases: crosslinking enzymes with pleiotropic functions. Nat. Rev. Mol. Cell. Biol., 4, 140-156 (2003)
- 人見 清隆 : トランスグルタミナーゼによるタンパク質修飾. 生化学, 77, 552-558 (2005)
- Fesus, L. et al. : Induction and activation of tissue transglutaminase during programmed cell death. FEBS Lett., 224, 104-108 (1987)
- Strnad, P. et al. : Transglutaminase-2 regulates Mallory body inclusion formation and injury associated liver hypertrophy. Gastroenterology, 132, 1515-1526 (2007)
- Fesus, L. and Piacentini, M. : Transglutaminase 2: an enigmatic enzyme with diverse functions. Trends Biochem. Sci., 27, 534-539 (2002)
- Huh, C.G. et al. : Hepatocyte growth factor/c-met signaling pathway is required for efficient liver regeneration and repair. Proc. Natl. Acad. Sci. USA, 101, 4477-4482 (2004)
- Liu, Y. : The human hepatocyte growth factor receptor gene: complete structural organization and promoter characterization. Gene, 215, 159-169 (1998)
- Tatsukawa, H. et al. : Role of transglutaminase 2 in liver injury via cross-linking and silencing of transcription factor Sp1. Gastroenterology, 136, 1783-1795 (2009)
- Giebeler, A. et al. : c-Met confers protection against chronic liver tissue damage and fibrosis progression after bile-duct-ligation in mice. Gastroenterology, 137, 297-308 (2009)
- Strnad, P. and Omary, M.B. : Transglutaminase cross-links Sp1-mediated transcription to ethanol-induced liver injury. Gastroenterology, 136, 1502-1505 (2009)










