Master's Perspective
肝臓における小型肝細胞
三高 俊広
日本医療大学 保健医療学部 看護学科
(前札幌医科大学 医学部附属研究所 再生医学研究所 組織再生学部門)
動物成体肝臓の主たる機能を担っているのは成熟肝細胞(Mature hepatocytes, MHs)であり、構成細胞の約60%、体積で約80%を占めている。肝細胞はほぼ同じような形態を示し、広い細胞質に核小体がはっきりしたほぼ正円の核を1つか2つ持つため、その不均一性を形態から判別することは困難である。消化管からの血液は門脈を介してグリソン鞘から中心静脈へ流れる。そのため、小葉内の存在位置により肝細胞の代謝機能に大きな違いがあることはよく知られていた。成体ラット・マウスでは、2/3部分肝切除後(2/3partial hepatectomy, PH)の肝再生時に3H-thymidineを投与すると、ほぼ全ての肝細胞が取り込まれることから(Grisham JW 1962, Bucher NLR 1964, Fabrikant JI 1968, Stöcker E 1971)、増殖能力に差はなく、残存する全ての肝細胞が一回か二回、理論上約1.7回分裂すれば元の重量に回復すると考えられてきた(Michalopoulos GK 2007, Fausto N 2004, Duncan AW 2009)。しかしながら、肝細胞をラベルして2/3PH後の肝再生過程を詳細に調べると、細胞分裂する肝細胞は半数に過ぎず、二核の肝細胞がDNA合成を行わずに2つの単核細胞に分裂することもあった。部分切除後のマウス肝再生では、肝細胞の肥大と増殖がほぼ同等に寄与しているのである(Miyaoka Y 2012)。つまり残存する肝細胞の機能が障害されない部分肝切除後の肝再生では、失われた肝細胞を補填するために肝幹細胞が動員される必要はない。他方、ヒト肝疾患や肝障害動物モデルでは、肝細胞に対する障害の程度は様々であり、病因により肝再生機序が異なる。本総説では、肝臓における小型肝細胞(Small hepatocytes, SHs)の役割について、私がこれまで行ってきた研究を元に考えてみることにする。初代培養肝細胞の増殖と小型肝細胞については、既に肝細胞研究会のHP(2008年11月25日)に記載しているので、本稿ではそれ以降の研究を中心にまとめている。
1. はじめに
個体を構成する臓器・組織は、それぞれ固有のホメオスターシスで維持されている。それゆえ、構成する細胞のターンオーバー速度もそれぞれに異なっている。細胞のrenewalの研究は、主に表皮、血液、消化管など、ターンオーバーの速い組織を用いて行われてきた(Leblond CP 1964, Weinstein GD 1984, Umar S 2010)。小腸や皮膚の上皮細胞のように、1〜4週間程度で細胞が入れ替わるようなターンオーバーの速い組織では、幹細胞に依存した細胞供給システムが確立されている。一方、肝臓は、幹細胞が肝細胞を供給するシステムで細胞数は維持されていない。
成熟肝細胞(MHs)の寿命は長く、ラット・マウスでは約6ヶ月、ヒトでは約2年と推定されている(MacDonald RA 1961, Steiner JW 1966, Bucher NLR 1971)。肝臓は、様々な機能を持ち生体維持に不可欠な臓器であり、その機能の2/3が失われても、生体のホメオスターシスを維持できるだけの予備能を有している。外科手術や薬剤障害により肝細胞数の2/3が失われた場合でも、肝臓は残存した肝細胞の分裂により、ラット・マウスでは7〜10日で元の重量に戻る。
肝機能が著しく低下し、直ちに回復できない場合、肝臓に備わっている幹細胞・前駆細胞系が活性化することは半世紀以上前から知られており、肝幹細胞および前駆細胞として、それぞれオーバル細胞(Oval Cells: OCs)および小型肝細胞(SHs)が知られている。OCsは、乏しい細胞質に楕円形の核を有することから名付けられた(Farber E 1956)。門脈域から小さな上皮細胞が放射状に伸び、肝細胞索に沿って管状構造を形成する、あるいは小集団を形成して門脈域の小葉側に存在する。そのため、OCsは肝細胞間に形成される毛細胆管(bile canaliculi, BCs)と胆管(bile ducts, BDs)が連結するヘリング管(Canal of Hering, CoH)細胞、あるいはグリソン鞘の小胆管周囲の間葉系細胞に由来すると考えられている。胆管上皮細胞(Biliary epithelial cells, BECs)[keratin (Krt) 7/19, OV-6, OC-2, Epithelial cell adhesion molecule (EpCAM), Sox9, Connexin 43]、肝芽細胞(Hepatoblasts)[a-fetoprotein (AFP), γ-glutamyltranspeptidase, protein delta homolog 1/preadipocyte factor 1 (Dlk)1, muscle pyruvate kinase]、造血幹細胞(Hematopoietic stem cells, HSCs) (c-Kit, CD34, flt-3, Thy1)のマーカーが組み合わされて発現している(Hixson DC 1990, Lemire JM 1991, Petersen BE 1998, Alison MR 2003, Dabeva MD 2003, Jensen CH 2004, Gronzdanov PN 2006)。OCsはSHsを介してMHsに分化することができるが、全てのOCsが肝細胞に分化するわけではない。OCs由来のSHsは、小胆管の小葉側又は小胆管に隣接する小葉内に出現する。この細胞は、丸い核と明瞭な核小体を持つ多角形の形状をし、形態的には小さいことを除けば肝細胞と区別出来ない。さらに、この細胞は AFPとアルブミンの両方を発現する(Hixson DC 1990, Lemire JM 1991, Dabeva MD 1993)。しかしながら、肝細胞消失や損傷により肝臓機能が損なわれた場合に、OCsが必ずしも活性化されるわけではない。OCsが活性化されるか否かは、残存する肝細胞が即座に増殖し、早期に肝機能を回復できるかどうかによる。OCsが活性化される場合であれ、肝細胞が主体的に増殖する場合であれ、SHsが出現し、その再生過程に深く関与していることに間違いはない。
SHsは肝細胞と同様の形態を示し、典型的なMHsより小さい細胞と定義できる。SHsは、in vivo (Lemire JM 1991, Gordon GJ 2000a, Roskams TA 2004)ばかりではなく、in vitro (Mitaka T 1992, Tateno C 1996) においてもその存在が証明されている。OCsに関する優れたレビューは、これまでに多数報告されている。詳しくはそれらを参照してほしい(Sell S 2001, Forbes SJ 2002, Alison MR 2003, Dabeva MD 2003, Thorgeirsson SS 2003, Fausto N 2006, Knight B 2005, Roskams TA 2006, Miyajima A 2014, Michalopoulos GK 2015, Stanger BZ 2015, Gadd VL 2020, Ko S 2020)。本総説では、主にラットの肝臓に出現する「小型肝細胞(SHs)」を中心に解説する。この細胞は、いつ、どのように、そしてなぜ肝臓に出現するのか、また肝疾患におけるSHsの役割についても述べることとする。
2. 肝細胞の増殖能とHeterogeneity
成体肝臓における、細胞のターンオーバーが著しく遅い。成人肝臓で見られる細胞分裂像は、20,000〜40,000個に1個である(Bucher NLR 1971)。しかし、齧歯類の哺乳期の肝細胞の分裂活性は非常に高く、ほぼ全ての肝細胞が活発に分裂し、肝重量も急速に増加する(Magami Y 2002)。実際、出生時には16-18%の肝細胞がDNA合成を行っており、肝小葉全体に均一に分布している(Hoffman PJ 1964, LeBouton AV 1970)。その後、肝小葉内の存在位置によって、肝細胞の増殖能に違いが出てくる。ラットでは、早ければ生後1日目に、Zone3のDNA合成を行っている肝細胞数は急速に減少し、3日後にはZone2の肝細胞にも同様の現象が認められる。10-12日齢になると、S期の肝細胞は小葉全体のわずか6%に減少し、その細胞の80%はZone1に存在していた。24週齢になると、S期の肝細胞数は0.2%以下になる(LeBouton AV 1970)。
肝細胞のin vitroでの増殖能力は、成熟に伴って徐々に低下することが知られている。最適なホルモン条件下では、哺乳期の肝細胞の大部分はDNA合成と細胞分裂を起こすが、成熟肝細胞では、DNA合成後に細胞分裂を起こす細胞は限られていた(Baribault H 1985)。3週齢のラット肝臓から分離した肝細胞は、少なくとも6日目まではほとんどすべての細胞が増殖するのに対し、4週齢以降、分離した肝細胞の増殖能に不均一性が見られ、増殖しない細胞が出現する(Mitaka T 1993a)。ラットでは、出生時に5~25%の肝細胞が3H-thymidineでラベルされるが、週齢が増すにつれラベルされる肝細胞数が減少し、成熟肝細胞では0.1%程度まで減少すると報告されている(Grisham JW 1969, Wright N 1984)。さらに、老化したラット肝細胞では、細胞分裂の回数と3H-thymidineのDNAへの取り込みが若いラットに比べてはるかに少ない(Bucher NLR 1963, Stöcker E 1971, Schapiro H 1982, Sawada N 1988)。これらの結果は、細胞分裂を停止した肝細胞の集団が年齢とともに増加し、限られた数の肝細胞がより多くの増殖サイクルを経て再生を果たすことを意味している(Popper H 1986)。つまり、離乳後の肝細胞には、増殖能力の不均一性がはっきり認められるのである。
肝細胞の増殖能が高いことは、肝細胞の移植実験でも示されている。albumin-urokinase-type plasminogen activator(Alb-uPA)コード配列をalbumin/enhancer/promoterに融合したトランスジーンを持つマウスでは、新生仔の約半数が出生後数日以内に致死する(Heckel JL 1990)。 生き残ったトランスジェニックマウスの肝臓では、融合遺伝子(Alb-uPA)欠損肝細胞が選択的に増殖してクローン性の結節を形成している。肝臓全体が置き換わった個体も存在した(Sandgren EP 1991)。わずか2個の結節で肝臓全体の90%以上を占める個体もいた。さらに、β-gal遺伝子を導入した肝細胞をAlb-uPAトランスジェニックマウスの肝臓に移植すると、ドナー由来の肝細胞とAlb-uPA遺伝子を欠損した内因性肝細胞の両方の結節がクローン的に拡大して、損傷した肝細胞の代わりに肝臓の広い面積を占めるようになった(Rhim JA 1994)。著者らは、移植した肝細胞の7%以下の細胞が結節を作り、ドナーおよび内因性肝細胞が少なくとも12回は分裂し、広範囲に増殖したと推定した。さらに、major urinary protein-urokinase-type plasminogen activator (MUP-uPA) 融合トランスジーンを持つ致死性マウスの肝臓に正常マウス肝細胞を移植した研究で、ドナー細胞が移植後約12回の細胞分裂を行っていることが示された(Braun KM 2000)。Fumarylacetoacetate hydrolase (FAH)欠損マウスは、毒性中間体であるfumarylacetoacetateの蓄積による肝細胞死により、出生直後に死ぬ(Grompe M 1993, Kelsey G 1993)。そのFAH欠損マウスを、わずか1000個の肝細胞を移植するだけで救命し、肝機能を回復させることができる(Overturf K 1996)。また、肝細胞を移植したマウス肝臓から分離した肝細胞を再移植するという連続移植マウスを用いた研究から、最初に移植した肝細胞が69回以上分裂すると推定された(Overturf K 1997)。成熟肝細胞の増殖能力の上限は不明であるが、成熟肝細胞の亜集団、おそらくSHsが、驚異的な細胞分裂能力を有していることは確かである。理論上、1個の肝細胞から肝臓全体を再構成するには28回の細胞分裂(228細胞)で十分である。一方、MHsの増殖能を研究するために、Kennedyらは肝細胞に限定して発現するα1-ATプロモーター下流でβ-galが発現するトランスジェニックマウスを用いた (Kennedy S 1995)。新生仔肝臓にβ-galactosidase (β-gal)陽性肝細胞がsingleあるいはdoubletの状態でランダムに散見され、加齢に伴いβ-gal陽性細胞はより大きなクラスターを形成するが、門脈周囲領域や中心静脈周囲に偏在することはないことを報告している 。さらに、Bralet M-Pらは、2/3部分肝切除後のラット肝臓にβ-gal遺伝子を持つレトロウイルスベクターを投与し、肝細胞をラベルした(Bralet M-P 1994)。ラベルされた肝細胞は週齢を重ねるにつれクラスターを形成したが、小葉内におけるラベルされた肝細胞の分布は生涯を通じて変わらなかった。
3.In vitroでの小型肝細胞の増殖
初代培養ラット肝細胞をnicotinamideとepidermal growth factor (EGF)やhepatocyte growth factor (HGF)などの増殖因子を加えて培養すると、SHsが出現する(Mitaka T 1992)。SHsの最初の分裂は、播種後2,3日目に観察され、SHsは増殖してコロニーを形成する(Mitaka T 1995a)。コロニーの大きさは様々であり、拡大し続けるものもあれば、比較的短い培養期間で増殖が止まるものもある。類洞内皮細胞(Sinusoidal endothelial cells, SECs)は数日以内に消滅し、混入したMHsは2〜3回分裂する程度でコロニーを形成することはない。ほとんどのSHsは1ヶ月以上生存できるが、培養を続けるとコロニー内の多くのSHsがアポトーシスによって突然死し、生き残ったSHsが再び増殖してコロニーが拡大する。栄養状態に依るのかもしれない(確認していない)が、dish全体を占有するコンフルエントの状態にまで増殖することはなかった。SHsは死と新生を繰り返しながら、5ヶ月以上培養することができる。多くのSHsは、NPCsと相互作用することにより(Mitaka T 1999)、あるいはEngelbreth-Holm-Swam (EHS)ゲル(Matrigel®)と接することにより(Sugimoto S 2002)、成熟肝細胞と同等な分化機能を持つ細胞に成熟する。一方、SHsは、collagen gel上で1% Dimethylsulfoxide (DMSO) を添加して培養すると、非実質細胞(nonparenchymal cells, NPCs)の増殖は抑制されSHsのみが成熟化することなく増殖を続ける(図1B)。つまり、SHsが成熟化するためには、SHsとNPCsの相互作用による基底膜の構築が必要であることがわかった(Sugimoto S 2002, Mitaka T 2002)。また、初代肝細胞は凍結保存すると増殖できないが、SHsは長期凍結保存後もその性質を維持したまま培養することができる(Ikeda S 2002, Ooe H 2006; 2009)。
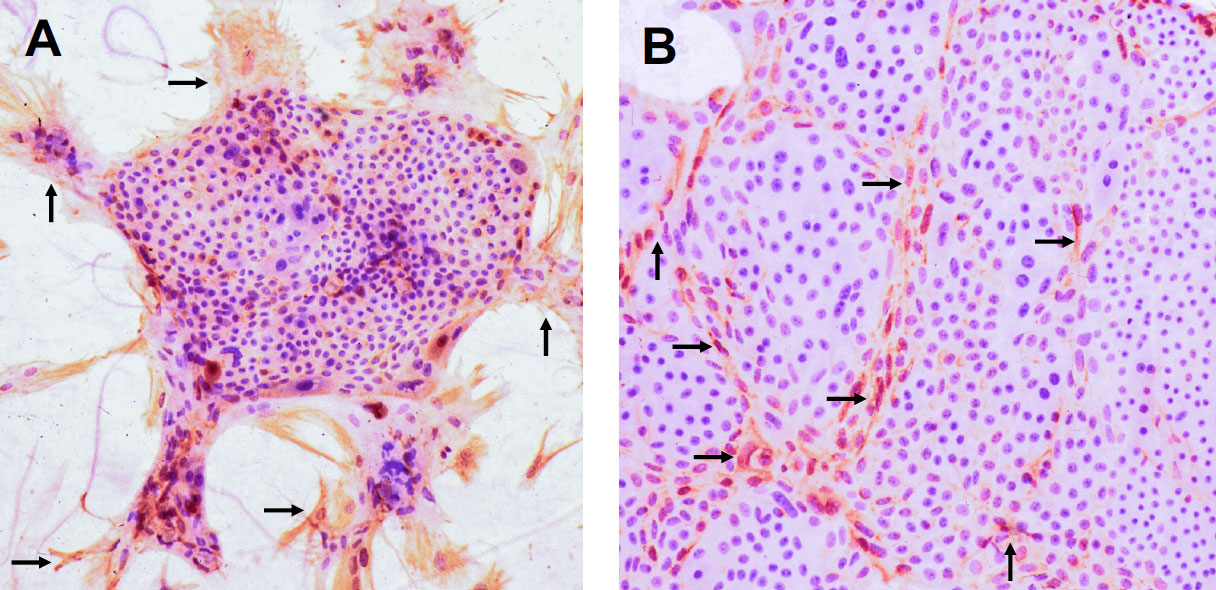
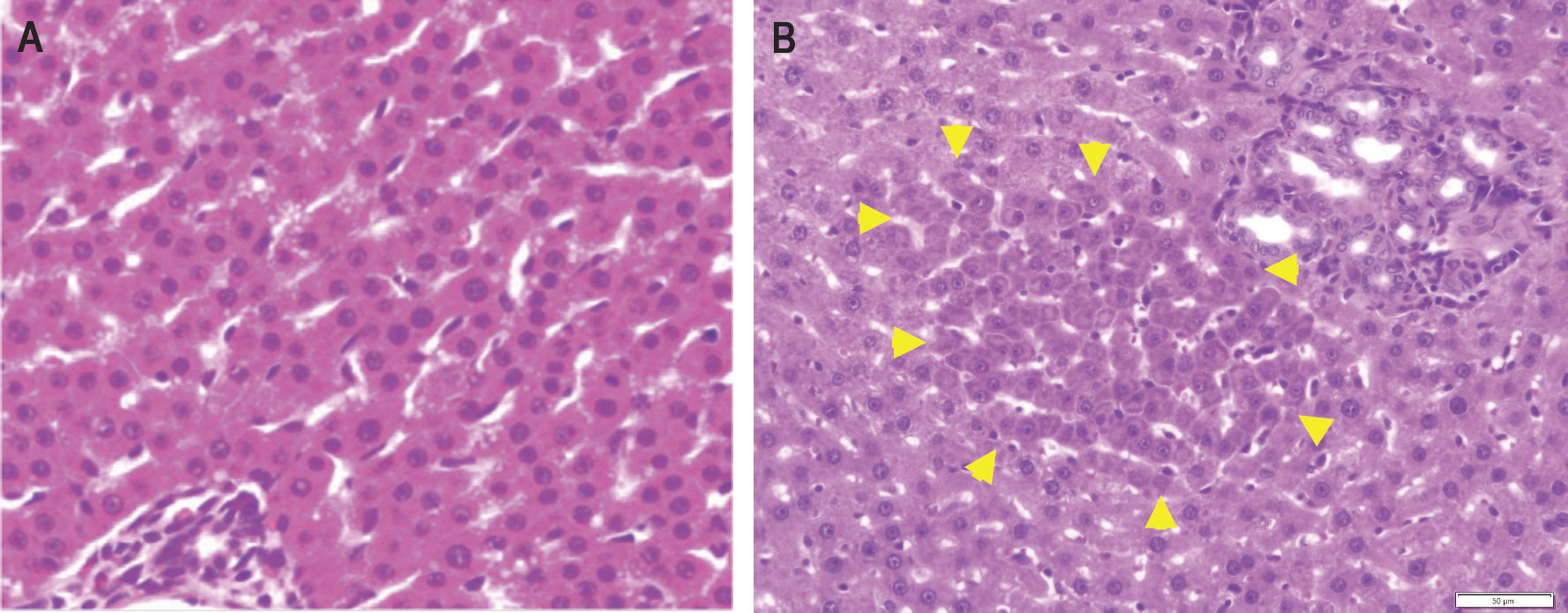
図1 非実質細胞分画の細胞をコラーゲンゲル上に播種し、4日目に1% DMSOを添加(B)または添加せずに(A)20日間培養。エタノールで固定後、Krt8で免疫染色した。Hematoxylinで核染色を行っている。非実質細胞が非特異的に茶褐色に染まっている(黒→)が、DMSOを添加して培養したコロニーの小型肝細胞のKrt8の染色性は弱く、細胞質の広い細胞が増えている。
上述のように、SHsとNPCsが混在している非実質細胞画分を得るには、コラゲナーゼ肝灌流して分離した細胞を低速遠心でMHsを除き、上清を遠心分離するという多段階遠心分離が標準的な方法である。しかし、この分離プロトコールで採取した細胞を培養すると、混在するNPCsも同時に増殖する。特異抗体を用いてSHsを選択的に分離することを目的に、DNA microarrayを用いてSHsの特異的表面マーカーを探索した。網羅的解析の結果、SHsに特異的に発現しているが、MHsでは発現していない分子としてCD44を同定した(Kon J 2006)。CD44はヒアルロン酸(hyaluronic acid, HA)、コラーゲン(collagen, Col)、フィブロネクチンなどの細胞外基質(Extracellular Matrix, ECM)との接着に必要なレセプター蛋白質である(Goodison S 1999)。CD44遺伝子の転写産物は複雑な選択的スプライシングを受けるため、機能的に異なる多くのアイソフォームが存在する。SHsは、CD44標準型(CD44s)とバリアント6型(CD44v6)を発現している(Kon J 2006)。CD44sは播種後3日目から免疫染色で陽性となる。CD44v6はCD44sより遅れて発現するが、両CD44の発現はSHsが成熟すると消失する。正常なラット肝組織ではCD44陽性肝細胞を同定することはできないが、Galactosamine (GalN) などの薬剤によって肝細胞が重度に障害されると、CD44陽性肝細胞が一過性にperiportal領域に出現する(Kon J 2006; 2009)。正常成体ラット肝臓や2/3PH後の再生肝臓から、CD44陽性細胞を分離することはできないが、GalN処置ラット肝臓からは可能である。NPCsの中では、SECsだけがヒアルアドヘリン、LYVE-1、スタビリン-1/2などHAに対するレセプターを発現しているが、CD44は発現していない(Mouta Carreira C 2001, Hansen B 2005)。これらの知見に基づき、CD44のリガンドであるHAを用いてSHsを選択的に分離することにした。
非実質細胞画分をHA-coated dishesに播種すると、SHsは選択的に増殖しコロニーを形成する(Chen Q 2007)。HAの効果は、入手可能なHA種間で違いはないが、無血清培養液中でSHsが増殖するには、nicotinamideとEGFなどの増殖因子に加えて、transferrinとseleniumが必要である。SHsは、播種後8-10日後に30-40個の細胞からなるコロニーを作る。培養2週間目頃より、SHコロニーは徐々にHA-coated dishesから剥離しやすくなり、trypsinなしでSHコロニーを回収し凍結保存することができる(Chen Q 2007)。長期間凍結保存されたSHコロニー は、Col-I-coated dishesに播種すると、増殖及び成熟化の能力を失うことなく増殖する(Ooe H 2006; 2009)。
SHコロニーは、培養初期には一様の形態を示した。小型の単核細胞が増殖しコロニーを形成する一方で、大きな細胞質と核、時には二核を持つMHsに類似した特徴を持つ細胞からなるコロニーが現れた(Chen Q 2007)。この所見はSHsの集団の中にもHeterogeneityが存在し、SHsの親細胞に相当する細胞が存在することを示唆している。親SHsを同定するためには、SHsが世代を重ねても自己複製能力を保持していることを証明する必要がある。そこでまず、コロニーから分離した一個のSHが増殖できる条件を探索した(Ishii M 2017)。
SHsは無血清培養液を用いてHA-coated dishで9-10日間培養した。trypsinによる細胞障害を避けるため、collagenaseとhyaluronidaseを用いてコロニーを剥離した後、抗CD44抗体を用いて純化した。CD44陽性 SHsは、Col-I-coated dishやHA-coated dishに再播種してもコロニーを形成しなかったが、Matrigelを薄く塗布したdish(Matrigel-thin-coated dish)上に播種すると、一部の細胞は増殖しコロニーを形成した(Ishii M 2017)。
Matrigel-thin-coated dish上に播種した細胞の多くは接着しなかったが、少数の細胞は接着し増殖する。コロニーを形成する細胞は当初、小型で単核であるが、培養経過とともに構成する細胞が異なる2種類のコロニーに分かれる。小型の単核細胞からなるほぼ正円型を示すコロニーと、大きな細胞質を持つ単核細胞、時に2核を持つ細胞からなる不規則な形態を示すコロニーである。コロニーの大きさも様々であった。典型的なSHsである小型の単核細胞からなるコロニーは急速に拡大して大きなコロニーを形成するが、比較的大きな細胞からなるコロニーはゆっくりと増殖する。この所見は、親SHsが娘細胞を産生していることを示唆している。4週間毎に継代培養を行ったところ、Matrigel-thin-coated dishに接着できた細胞は、播種した細胞の20%程度であり、それらは小型の典型的なSHsの形態を維持していた。増殖能の高い親SHsは、17週間で50回以上分裂した。我々は、増殖能の高い細胞を肝親前駆細胞(Hepatocytic parental progenitor cells, HPPCs)と呼ぶことにした(Ishii M 2017)。
HPPCsがMatrigel-thin-coated dishのみで増殖できたという事実は、Matrigelに含まれる特定成分がHPPCsの自己複製能力(Self-renewal ability)を維持するのに重要であることを示唆している。Matrigel®は、Laminin(LN)、Col-IV、Nidogen、Heparan sulfate proteoglycansなど基底膜を構成する成分からなる(Kleinman HK 1982, Nishiuchi R 2006)。これらの成分のうち、LNは主要な接着タンパク質として、細胞の基底膜への接着を仲介している。LNは、α, β, および γ鎖 と呼ばれる3本のポリペプチド鎖から構成されており、哺乳類では5種のα鎖 (α1-5)、3種のβ鎖(β1-3)、3種のγ (γ1-3)鎖が知られている(Yamada M 2015)。Matrigel®は主要成分としてLN111(α1, β1, γ1)を含んでいる(Kleinman HK 1982)。LNα1鎖はラットの胎仔および出生直後の肝小葉内では発現しているが、成体肝では見られない。代わりに、LNα5鎖がGlisson鞘内に限定的に存在する(Kikkawa Y 2005)。しかしながら、LNα1 が2/3PH後の再生肝で一過性に発現することが報告されている(Kikkawa Y 2005)。Integrinは、細胞膜レセプタータンパク質でLNとの接着において中心的な役割を果たしている(Yamada M 2015)。Integrinは、非共有結合したα とベータ のサブユニットから構成され、哺乳類では、α とβサブユニットの異なる組み合わせからなる少なくとも24種類のIntegrinsが同定されている。LN- Integrin相互作用の特異性は主にLNのα鎖に依存し、Integrinのリガンド特異性は主にαサブユニットによって決定される。βサブユニットは、その特異性において補助的な役割を果たしている(Nishiuchi R 2006, Yamada 2015)。
Matrigel-thin-coated dish上と同様に、LN111-coated dishに接着したSHsは、播種した細胞の20%以下であった(Kino J 2019)。細胞の接着率は、Matrigel上よりもLN111上の方がわずかに低かった。LN111上で増殖したSHsを継代しても、新たなDish上に接着する細胞数の割合はほとんど変わらず、播種した細胞の20%以下であった。この割合は継代を重ねるごとに徐々に減少した。このことは、HPPCsの数が継代とともに減少することを示唆している。さらに、LN111に接着できなかった細胞の多くは、LN511-coated dishには接着したが、LN511上でHPPCs相当の細胞が出現することはなかったことから、LN511上で増殖する細胞は自己複製能を失っていると考えられた。このように、HPPCsは2つの特徴的な細胞集団を供給している。これはHPPCsが非対称的な細胞分裂を行っていることを示しているのかもしれない;一方の細胞集団はLNα1依存性であり、もう一方はLNα5依存性である。HPPCsの自己複製能はLN111依存性であるが、LNα5依存性の娘細胞の生存と増殖は、付着したHPPCsが産生するLNα5によって支持されているのかもしれない(Kino J 2019)。LN結合に関与するIntegrinのうち、LN111上で増殖するSHsは、Integrin α3 とβ1 をLN511上で増殖する細胞よりも強く発現していたが、LN511上で増殖する細胞は、Integrin β4 をより強く発現していた(Kino J 2019)。また、Integrin α3highα6β1high細胞は、LN111上でHPPCコロニーを形成したが、Integrin α6β1low細胞はコロニーを形成しなかった。LN111とIntegrin β1、それぞれに対する中和抗体は、LN111上でのHPPCsのコロニー形成を阻害した(Kino J 2019)。これらの結果は、HPPCsの増殖にはIntegrin β1 を介したLN111からのシグナルが重要であることを示唆している。
免疫組織学的に肝組織におけるLNの発現を検討すると、マウスの胎仔肝臓では、LNα1 とα5 が胆管細胞の基底側に検出される一方、成体肝臓ではLNα5 のみがGlisson鞘内に認められた(Tanimizu N 2012)。ヒト人工多能性幹細胞(Human induce pluripotent stem cells, iPSCs)由来の肝芽細胞様細胞の自己複製能は、LN111上で維持されると報告されている(Takayama K 2013)。一方、未分化Human iPSCはLN511上で維持されるが、LN111上では維持できない(Rodin S 2010)。つまり、LN111は肝芽細胞様細胞を選択的に維持するだけでなく、残存する未分化細胞を除去することもできるのである。さらに、CD45-TER119-c-Kit-c-Met+CD29+CD49f+/low細胞(Suzuki A 2002)やCD45-TER119-c-Kit-Dlk+細胞(Tanimizu N 2003)は、マウス胎仔肝臓において高い増殖性と二分化能を有する。CD45-TER119-c-Kit-Dlk+細胞は、LN-coated dish上で高い増殖能を維持できることから、LN上で増殖する肝前駆細胞(hepatic progenitor cells proliferating on LN, HPPLs)と命名された(Tanimizu N 2004)。HPPLsはDlk+CK19+Albumin+であるのに対し、肝芽細胞はDlk+CK19-Albumin+であることから、肝芽細胞としての特徴を一部失っていると考えられるが、HPPLsは高い増殖能だけでなく、肝細胞と胆管細胞の両方に分化する二分化能を持っている。LNはHPPLs の増殖能と多分化能を維持するために重要な因子であることがわかる。さらに、HPPLsはIntegrin α6β1 を強く発現しており、LNからのシグナルはIntegrin β1 を介して伝達される(Tanimizu N 2004)。また、E13ラット肝臓から単離されたRT1A1-OX18lowICAM-1+細胞は、Integrin β1を発現し、LN上で増殖可能で二分化能を有する(Kubota H 2000)。さらに、成体ラット肝臓から分離されたRT1A1+OX18+ICAM-1+肝細胞も高い増殖能を持つことが報告されているが、この細胞は、STO胚性幹細胞株をフィーダー細胞としてEGFを含む無血清培地で培養する必要がある。一方、胎生後期および出生後のマウス肝臓から分離したintercellular cell adhesion molecule (ICAM)-1陽性肝前駆細胞は、継代後もLN111上で自己複製能力を維持することができる(Tanimizu N 2016)。したがって、肝細胞の特徴を持つ細胞の自己複製能は、LNα1 依存的に維持されている可能性がある。
遺伝子発現パターンも、LN111上の細胞とLN511上の細胞では異なっている。Cd44、Afp、Dlk-1ばかりではなく、Albumin(Alb)、カルバモイルリン酸合成酵素(Cps)1、グルタミン合成酵素(Gs)、Krts 8 & 18、Hepatocyte nuclear factor 4α(Hnf4α)、CCAAT/enhancer binding proteina(Cebpα)の遺伝子発現は、LN111依存細胞とLN511依存細胞の両方で認められた(Kino J 2019)。しかしながら、HPPCsにおけるAlb、Cps1、Hnf4α、Cebpα などの肝分化機能に関連する遺伝子発現の絶対値は、MHsに比べてはるかに低かった。Krts 7&19、Sox9、Epcamなどの胆管細胞関連遺伝子発現は、LN111上よりもLN511上で培養した細胞で高かった。一方、Thy1、c-Kit、Ncam1、Cd24などの肝幹細胞関連遺伝子発現は、LN511上よりもLN111上で培養した細胞で高かった。さらに、Cd34、leucine-rich orphan G-protein-coupled receptors(Lgrs)4/5、Axin2、telomerase reverse transcriptase(Tert)の遺伝子発現は、LN111でもLN511でも認められなかった(Kino J 2019)。最近のマウスの肝臓におけるlineage tracing研究により、健常あるいは障害条件下で肝臓を再生する特定の細胞集団の存在が報告されている。Sox9(Font-Burgada J 2015)またはMfsd2a(Pu W 2016)を発現するperiportal肝細胞、pericentralのAxin2陽性(Wang B 2015, Zhao L 2019)またはLgr5陽性肝細胞(Huch M 2013, Ang CH 2019)、および広範に分布するTerthigh(Lin S 2018)またはLgr4陽性肝細胞(Planas-Paz L 2016)が、肝臓の生理的状態において新しい肝細胞を生成する候補として報告されている。しかし、我々の研究結果は、HPPCsがそれらの亜集団とは明らかに異なる細胞集団である可能性を示している。
4. 増殖能の高い肝細胞は、小葉内のどこに存在するか?
私は以前、成体ラット肝臓の肝細胞には少なくとも3つの亜集団が存在すると提唱した(Mitaka T 1998; 2002)。タイプI細胞(MH-I)は、高い増殖能力と肝細胞の基本的な機能を持ち、分化の方向性が決まっている前駆細胞で、MHsに分化することができる。タイプII細胞(MH-II)は細胞の分裂回数が制限された細胞で、タイプIII細胞(MH-III)は、細胞分裂能力を失い(細胞老化F)、最終分化に至った細胞と定義した。
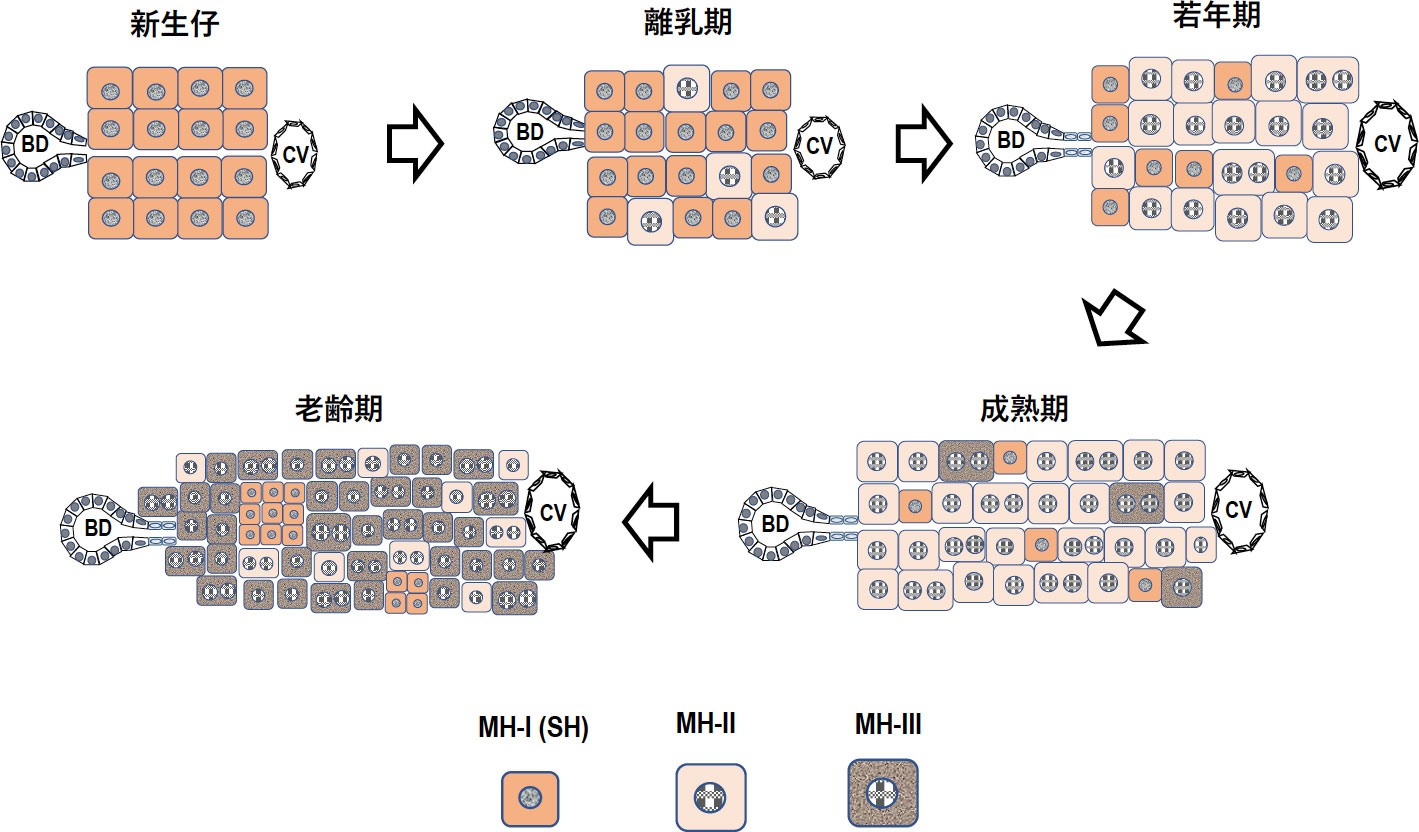
図2 肝細胞は3種類の細胞に分けられる。Type I(MH-I, SHs)、Type II、Type III細胞である。出生直後の肝臓は、Type I細胞からなり活発に増殖する。離乳期になるとType I細胞はType II細胞になり、急速に増殖し肝臓は大きくなる。若年期ではType I細胞は急速に減少し、肝細胞のほとんどはType II細胞になる。週齢を重ねるとType II細胞は細胞老化に陥り、Type III細胞になる。老齢になると肝細胞の多くはType III細胞になり徐々にapoptosisに陥り脱落する。死んだ細胞をMH-II細胞が補填できなくなると、Type I細胞が代わりに増殖し、小集塊(foci)として顕在化する。(参考文献Mitaka T 2023のFigure 2を改変)
図2はラット肝臓の成長と上述の3タイプの肝細胞の関係を模式的に表したものである。出生直後は、ほぼすべての肝細胞(MH-I)は肝芽細胞と同等の増殖能を持ち、活発に増殖し肝臓は急速に成長する(図3A)。肝細胞の増殖能の不均一性(Heterogeneity)は離乳期に顕在化する。離乳後、MH-Iの多くは増殖能が制限されたMH-IIになり、MH-II細胞は急速に増殖し肝臓は大きくなる。その結果、MH-Iの集団が減少し、前駆細胞としての能力を維持したMH-Iは、肝臓の小葉内にランダムに分布するようになる。加齢とともにMH-IIは細胞老化(replicative senescence)し、MH-IIIが増加する。実際、老化したラットのMHsは若いMHsに比べてActAやp15INK4bの発現が増加し、増殖能が低下していることが報告されている(Menthena A 2011)。また、老齢ラット肝臓では、SHsの小集塊(foci)が小葉全体に観察される(図3B)(Mitaka T 1987)。この所見は、老化したラットの肝臓では細胞老化になり増殖刺激に反応できないMH-IIIの代わりに、MH-Iが選択的に増殖している可能性を示唆している。
活発に増殖する肝細胞の小葉内のランダムな分布に関して、spfashヘテロ接合体雌マウスのモザイク肝臓を用いた研究が報告されている(Shiojiri N 1997)。spfash変異はX染色体上に存在し、ホモ接合体雌ではornithine transcarbamylase(OTC)欠損による新生仔高アンモニア血症を引き起こす(DeMars R 1976)。ヘテロ接合体の肝臓では、OTCタンパク質を発現している肝細胞とその10分の1の活性を持つ細胞がモザイク状に分布している。発生過程では、肝細胞は増殖し広範囲に移動するが、成体肝臓では、親細胞と同じOTC発現強度を示す娘細胞は親細胞に接して存在し、その分裂方向はランダムであるため、三次元的に連続した大きな肝細胞集塊を形成していた(Ng Y-K 1992, Khokha MK 1994)。
これらの結果は、MH-Iが小葉全体にランダムに分布しているという我々の仮説を支持するものであり、periportalに存在する幹細胞が分裂し、その娘細胞が中心静脈に向かって徐々に移動し、pericentral領域でapoptosisにより死ぬというZajicekらが提唱した「肝細胞ストリーミング理論」(Zajicek G 1985, Arber N 1988, Sell S 1994)とは異なるものである。
- 閑話-
私が大学院生の頃の1980年代は、ラットを用いた化学肝発癌研究が盛んであり、化学物質の肝発癌作用やプロモーション作用の有無を早期に検定する手法の1つに前癌病変の同定があった。遺伝子変異した肝細胞はAFPなど胎児性タンパク質を発現するばかりではなく、細胞膜に存在するGGTやGlutathione-S-transferase placental type (GST-P)も細胞質に分布することから前癌病変のマーカーと考えられていた。私の博士論文は老齢ラット肝臓に出現する変異細胞巣(Foci)をGST-PやGGTの発現で同定し、その頻度を調べたものである(Mitaka T 1987)。この研究のキモは、老化ラット肝臓に自然発生的に出現する増殖巣のGST-PやGGTの発現に性差が有り、雄では90%以上が陽性であったが雌では80%以上の変異巣が陰性であったことである。多段階発癌のFirst stepの遺伝子異常が起こっているのならこれほどの性差は考えにくいのだが、超高分化な肝細胞癌の病理組織像は細胞の大きさやラベルの頻度を除けば正常肝細胞と区別が出来ない事から、老齢ラットの増殖巣を前癌病変と考えるのは妥当であった。しかしながら、SHsが存在し種々の病変で小型肝細胞の出現が見られることを考えればMH-IIが減少し、消失した肝細胞の穴を埋めるために残存するMH-Iである小型肝細胞が増殖した像と考えればGST-PやGGTに性差があっても矛盾はしないのではないかと考えている。
5. 肝小葉内に見られる小型肝細胞
SHsを正常肝組織内で識別することは困難である。小葉内に存在する肝細胞は、大小の違いはあっても形態的にはほぼ同様であり、特異的なマーカーが無い現状では、どの程度小さければSHsと呼んでよいのかわからない。離乳前のラット肝臓から分離した肝細胞の大きさは典型的なMHsよりも明らかに小さく(図3A)、その形態はSHsに近い。小さいサイズの肝細胞の出現頻度は、離乳後の年齢とともに劇的に減少する(Mitaka T 1993a)。Sigal SHらは、FACSを用いて、胎仔および哺乳ラット肝臓から分離した肝細胞はすべて単核で、肝芽細胞と同程度の粒状性(granularity)と自家蛍光(autofluorescence)を有することを示している(Sigal SH 1995)。一方、成体ラット肝臓においてもSHsの存在が報告されている。Tateno C らは、FACSによる粒状性と自家蛍光を元に、雄性F344ラット肝臓から単離した肝細胞が、SH-R3 (17.1 ± 0.2 μm)、SH-R2 (22.6 ± 0.5 μm)、PH (24.1 ± 0.5 μm)の3つの亜集団に分けられることを報告した(Tateno C 2000)。その後、Asahina Kらは、SH-R3の80%以上の細胞が単核の2倍体細胞であり、高い分裂能を有することを示した(Asahina K 2006)。
またラットやマウスの肝臓では、 [1] 2-acetylaminofluorene (2-AAF)/PH、[2] d-galactosamine (GalN)、[3] Retrorsine (Ret)/PHのような薬剤の投与と増殖刺激の組み合わせなど、様々な条件下での小型肝細胞の出現が報告されている。[4]ヒトの肝臓でも、急性あるいは慢性肝疾患において中間型肝細胞 (intermediate hepatocytes, IHs)の出現が報告されている。この項では、生体肝臓に出現する「小型肝細胞」について、文献や我々の経験に基づいて紹介する。
[1] 2-Acetylaminofluorene (2-AAF)/PHモデル
2-AAFは肝細胞においてDNAに直接作用し、DNA付加体を生成することが知られ、PH後の肝細胞の増殖を完全に阻害するために用いられる。この2-AAF/PHプロトコールは、最も信頼性の高いOCs誘導ラットモデルである(Evarts RP 1987, Sarraf C 1994, Alison MR 1996, Paku S 2004)。しかしながら、マウスの肝臓には2-AAFを活性化するN-sulfotransferaseがないため、この2-AAF/PH プロトコールをマウスに適用することはできない(DeBaun JR 1968)。OCsは、CD34、c-Kit、Thy1など造血幹細胞の膜タンパク質マーカーを発現することから(Petersen BE 1998)、OCsは骨髄細胞に由来すると考えられていた(Petersen BE 1999)。一方、Thy1が肝筋線維芽細胞(hepatic myofibroblasts)や肝星細胞(hepatic stellate cells, HSCs)にも発現していることからOCsの特異的マーカーとは言えないとの報告もある(Dudas J 2007, Dezsö K 2007)。それ故、Thy1がOCs の特異的マーカーであるかどうかについては、まだ議論の余地があるが、GalN投与ラット肝臓から単離したThy1陽性細胞に肝幹細胞/前駆細胞の集団が含まれていること明らかなことから、OCsがThy1を発現していることは間違いない(Kon J 2009, Ichinohe N 2013)。
OCs の肝細胞への分化過程には、2-AAFの投与量によって2つのパターンがある(Paku S 2004)。用量による違いは、PHの数日後から認められる(Paku S 2004-Figure 6を参照)。低用量の2-AAFで処理したラット肝臓では、OCs はまっすぐな管状に配列し、ほとんどのOCs は同期して小型のbasophilic SHs(bSHs)に分化する。OCs は管の胆管側に位置し、同じ管の小葉側はbSHsに分化している。新しく形成された肝細胞は、分化過程の初期段階においては管状構造を維持している。正常な小葉構造を回復するのは、PH後10〜12日目頃である。対照的に、高用量の2-AAFを投与した肝臓では、bSHsからなる細胞集塊が出現し、組織学的な基底膜は認められなかった。小細胞集塊を形成する新生肝細胞は、胆管側領域に限局せずに小葉全体に散在していた。肝小葉構造が再構築されるまでPH後約1ヶ月を要した。OCsの肝細胞への分化は、HNF4α の発現や基底膜の消失と相関し(Paku S 2004)、OCsの表現型は、hepatoblasts/BECs型の (AFP, OV-6, a6-integrin, Connexin (Cx) 43)から肝細胞型の(HNF4α, α1-AT, Cx32, BC形成)へと変化する。
[2] d-Galactosamine (GalN) モデル
GalNは強力な肝毒性物質であり、壊死またはアポトーシスによって肝細胞死を引き起こす。GalNは主にpericentral領域の肝細胞で代謝され、ウリジン ヌクレオチドを枯渇させることにより、転写阻害剤として働く(Decker K 1974, Bachmann W 1977)。GalNをラット腹腔内に投与すると、GalNで傷害を受けた肝臓では、3-5日後に通常見られない上皮細胞として、OCs、bSHs(<16 μm)及び肝細胞が管状構造上に現れる(Lesh R 1970, Medline A 1970, Lemire JM 1991)。bSHの数はGalN投与後4日目に最大となり、その後減少し、肝臓は8日目頃までに正常な小葉構造に戻る。
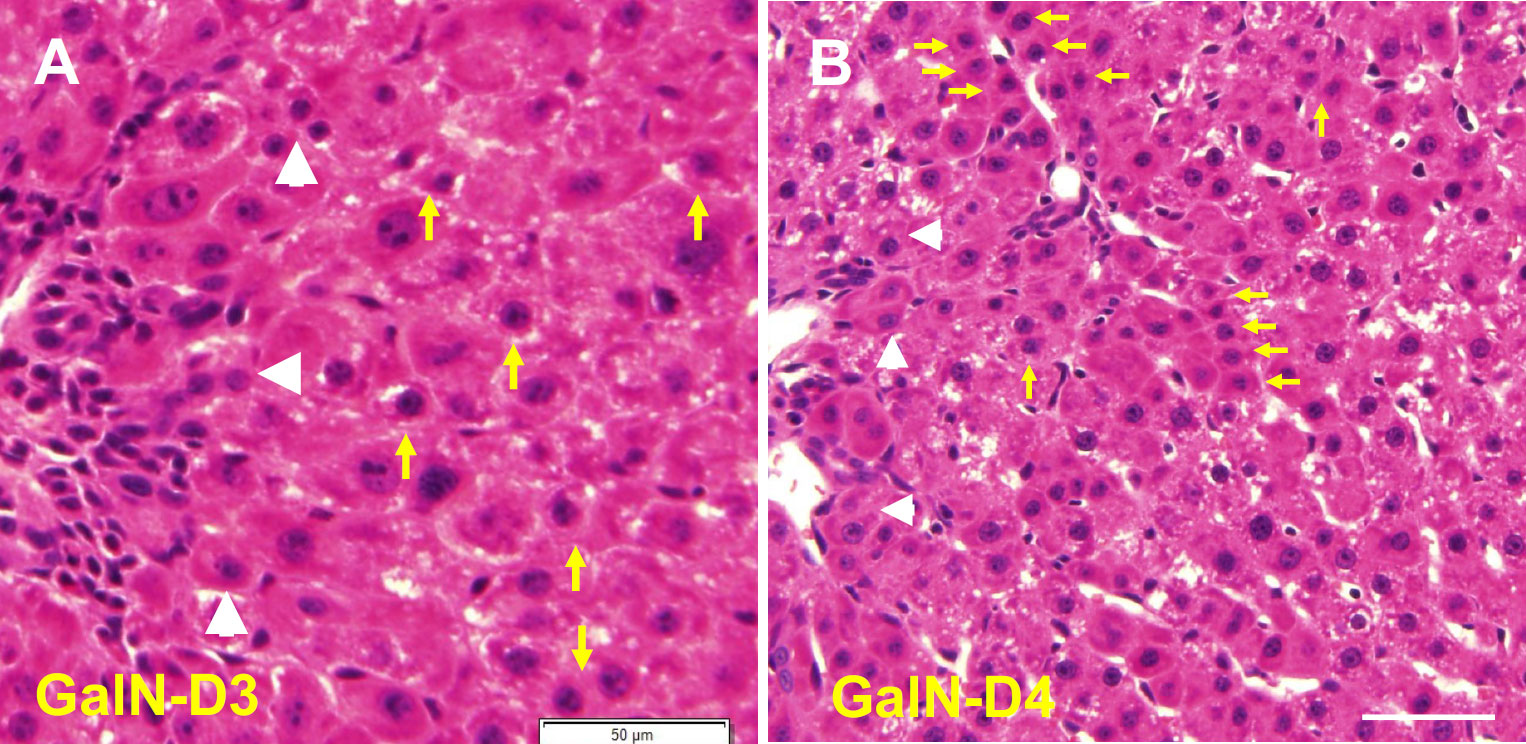
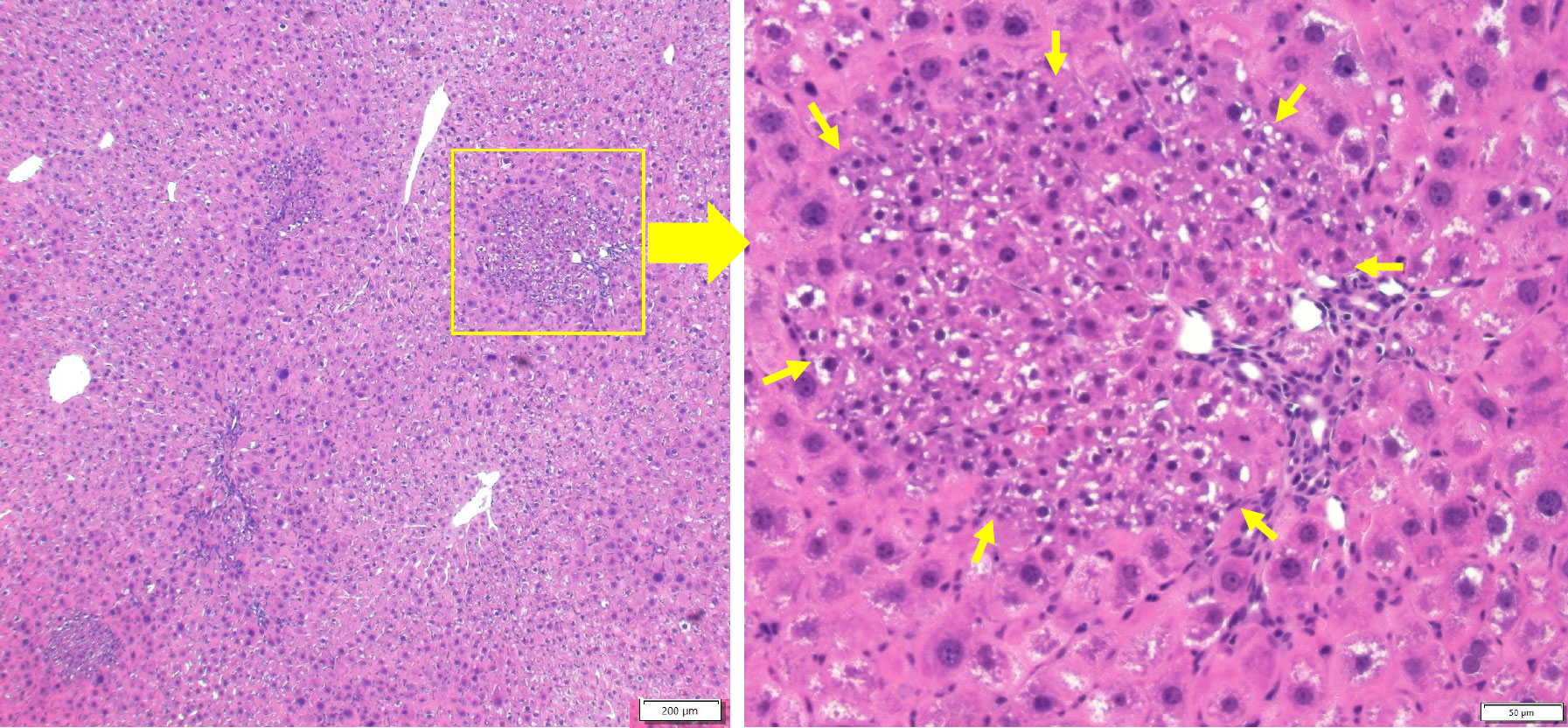
図4 Galactosamine (GalN)を腹腔内投与後、3日目(A)及び4日(B)のラット肝臓のHE染色写真。3日目(A)ではOCsが小葉内に伸長しその先端には円形の核をもつ小型肝細胞(白矢頭、bSHs)が存在し、より内側にはbSHsより大きな小型肝細胞(黄矢印)が認められる。4日目(B)には、OCs由来のbSHsは減少し、肝細胞由来の小型肝細胞が多く認められる。
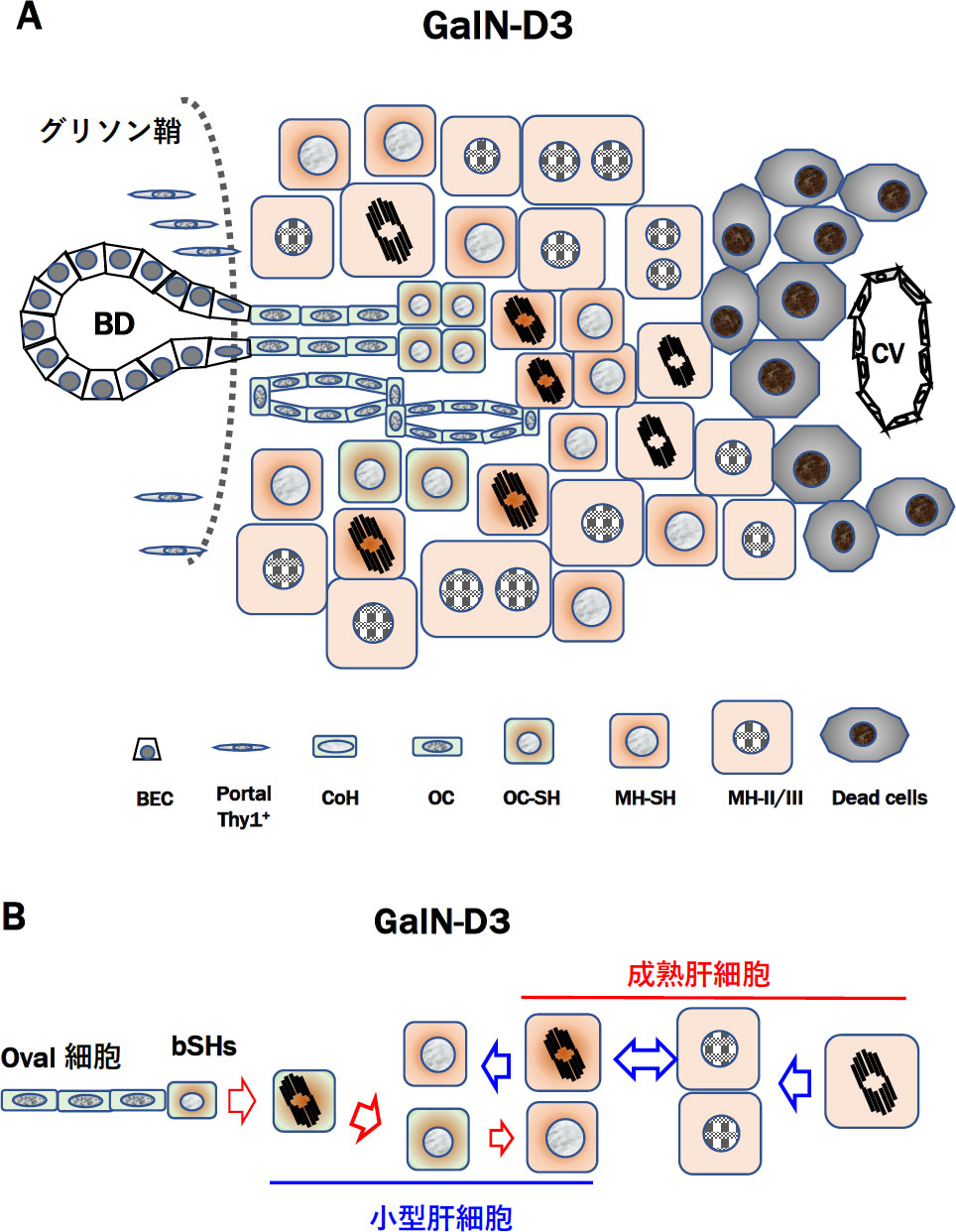
図5 GalN投与3日目のラット肝臓の上皮系細胞の図解(A)。門脈域(Zone I)には、OCsが増生し、その小葉側はbSHsに分化している。bSHsはType I細胞(SHs)と形態的に区別が困難。SHsが分裂増殖し顕在化する一方、残存した肝細胞(Type II細胞)も増殖を始める。(B)増生したOval細胞と生存した肝細胞に挿まれた部分にOval細胞由来と肝細胞由来のCD44陽性SHsが併存していると考えられる。
我々は、GalNで障害された肝臓においてbSHとは異なるSHsが出現することを報告していた(Kon J 2006)。ラットにGalNを投与すると、2日目にはThy1陽性細胞がperiportal領域に出現する。Thy1陽性細胞の出現に続いて、GalN投与後3〜5日目にCD44陽性 SHsが、Thy1陽性細胞と残存肝細胞の間の領域に一過性に出現する。CD44陽性SH数は4日目に最大になる一方、Thy1陽性細胞は急速に減少し、4日目には小葉内からほぼ消失した。その後、CD44陽性 SHsの数は急速に減少し、6日目にはCD44を発現している肝細胞を見つけることは困難だった。この結果は、GalN投与後3~4日目の肝臓には、由来の異なるSHsが混在していることを意味している。つまりOC由来のbSHsから分化したSHsと成熟肝細胞由来のSHsである(図5)。
このことは、GalN投与ラット肝臓からThy1及びCD44抗体で分離培養した細胞の検討からも裏付けられた。成体雄性F344ラットにGalNを投与した肝臓からSHs以外に星細胞、SECs、Kupffer細胞、Liver epithelial cells (LECs)を含む非実質細胞画分を分離すると、約1×108個の細胞が得られる。次に、抗Thy1抗体と抗CD44抗体をそれぞれ用いて、その細胞をThy1陽性画分とCD44陽性画分に分けた。GalN-D2から分離されたThy1陽性細胞は、ほとんどの細胞が紡錘形の線維芽細胞様の形態を示したが、GalN-D3から分離されたThy1陽性細胞は、形態学的に多角形(上皮細胞様、epithelial-like)と紡錘形(線維芽細胞様、fibroblastic)の2つのタイプに分かれた(Kon J 2009, Ichinohe N 2013)。主としてThy1+/desmin+を示す筋線維芽細胞の割合は約45%であったのに対し、Thy1+/Krt19+、Thy1+/Albumin+、またはThy1+/CD44+を示す上皮様細胞の割合は約55%であった。一方、GalN-D3から分離されたCD44陽性細胞の大部分は多角形の形態を示し、上皮細胞様であった。分離されたCD44陽性細胞は、Krt19、albumin、Thy1をそれぞれ約60%、62%、65%の割合で発現していた(Ichinohe N 2013)。Thy1+/CD44-、Thy1+/CD44+、Thy1-/CD44+細胞の割合は、それぞれ非実質細胞画分の約2.0 ± 0.5%、3.1 ± 0.3%、3.0 ± 0.6%であった(未発表データ)。さらに、CD44+/Krt19+細胞のサイズと特徴はThy1+/Krt19+細胞と同様であったが、Thy1-/CD44+細胞のコロニー形成能は、Thy1+/CD44-細胞とThy1+/CD44+細胞のコロニー形成能に比べて5倍高かった。加えて、CD44+/Albumin+細胞からなるコロニーの平均サイズは、Thy1+/Albumin+細胞からなるコロニーの平均サイズよりも大きかった。さらに、播種後10日目におけるCD44+(GalN-D4)細胞由来のコロニーの平均サイズは、CD44+(GalN-D3)細胞由来のコロニーの平均サイズより約2倍大きかった(Ichinohe N 2013)。
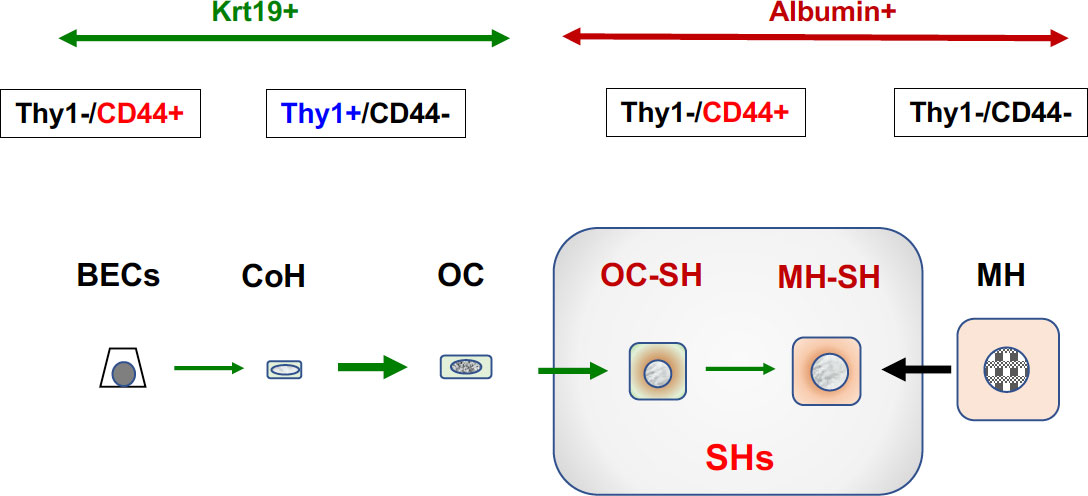
図6 GalN投与ラット肝臓における小型肝細胞の出現とその由来。Krt19の発現は、BECsの特徴であり、Albuminの発現は肝細胞の特徴である。BECsで発現しているCD44は、小葉内に一過性に出現する小型肝細胞の特異的マーカータンパク質でもある。GalN投与3日目の肝臓にはThy1陽性OCs由来とMHs由来のCD44陽性SHsが混在している。
GalN-D2のThy1陽性細胞からCD44陽性SHコロニーを誘導するためには、培養液にEGF、HGF、basic fibroblast growth factor (bFGF)を単独または組み合わせて添加する必要がある(Ichinohe N 2013)。一方、GalN-D2から分離されたThy1陽性細胞は、BEC誘導培地を用いたCollagen-sandwich培養でも胆管上皮細胞に分化できなかったが、GalN-D3から分離したThy1陽性細胞は、BEC誘導培地を用いてCollagen-sandwich培養すると、管状または嚢胞状の構造を形成した。この結果はGalN-D3から分離したThy1陽性細胞の中に、肝細胞とBECsのいずれにも分化できる二分化能を持つ細胞が存在することを示している。また、Thy1発現を失った細胞は、BECsへ分化できなかった(Kon J 2009)。Thy1陽性細胞が肝細胞へ分化することは、網羅的遺伝子発現解析によっても確認できた。GalN処理後2日目にperiportal領域に出現したThy1陽性上皮様細胞は、Thy1+/CD44-、Thy1+/CD44+、Thy1-/CD44+ SHs、最終的にThy1-/CD44-/C/EBPa+(MHs)細胞の順に分化すると考えられる(図6)(Kon J 2009, Ichinohe N 2013)。Ret/PH処置したラット肝臓にThy1陽性細胞を移植して、この細胞が二分化能を持っていることを確認した(Ichinohe N 2012)。一部のドナー細胞は肝細胞索に組み込まれ肝細胞に分化する。少数ではあるが、ドナー細胞由来の胆管も認められた。肝細胞分化とThy1発現消失の関係は、胎仔肝臓でも報告されている(Fiegel HC 2003, Lázaro CA 2003, Masson NM 2006, Oetel M 2007)。少数のThy1陽性肝芽細胞はAFP+Alb+Krt19+Ecad+であったが、肝芽細胞マーカー(AFP+ Krt19+ Alb+)を発現する細胞のほとんどはThy1陰性肝芽細胞であった(Oetel M 2007)。
これらの結果をまとめると、CD44陽性肝細胞は肝細胞の前駆細胞であり、GalN障害ラット肝臓に出現するCD44陽性細胞は、2つの異なる細胞から由来していると考えられる;1つはOCs由来であり、もうひとつはMHs由来である。新生肝細胞は、残存するMHsとOCsの両方に由来するが、GalN障害肝におけるOCsの増生が軽度である事を考慮すると、その大部分はMH由来の細胞であると考えられる。
[3] Retrorsine/partial hepatectomyモデル
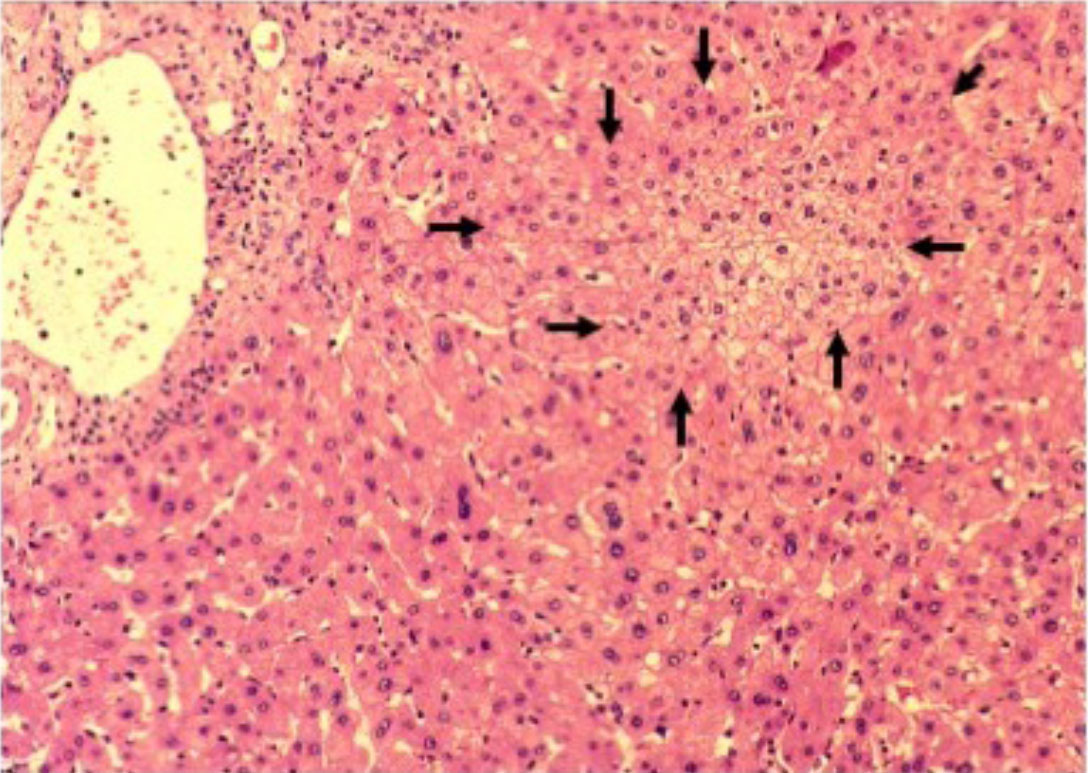
Retは、天然に存在するピロリジジン系アルカロイド化合物の仲間で、様々な哺乳類組織に毒性を示す(McLean EK 1970)。Retの肝毒性作用は長期間持続し、Retを投与されたラット肝細胞は、増殖が著しく阻害される。2/3PHや肝細胞壊死のような強い増殖刺激が肝臓に与えられると、Retを取り込んだ肝細胞は、細胞分裂出来なくなる。その結果、非増殖性の巨大細胞(巨細胞)が形成される (Laconi E 1995; 1998, Dabeva MD 1998, Gordon GJ 2000a)。Ret/PH処置されたラット肝臓では、肝細胞が増殖出来ないのでその代わりに、小型肝細胞のクラスターが小葉内に出現する(図7)(Oren R 1999)。クラスターを形成する細胞は内因性の肝前駆細胞とみなされ、Small hepatocyte-like progenitor cells (SHPCs) と名付けられた(Gordon GJ 2000a)。
SHPCsは、周囲の肝細胞とは形態的に異なる細胞として、PH後3日目くらいから認められ、増殖してクラスターを形成する。SHPCクラスターは、すべての小葉ゾーンで認められ(zone 1、2、3にそれぞれ31%、43%、26%)、periportal領域に限定されるものではなかった(Gordon GJ 2000a)。我々は、PH後14日目のSHPCクラスターの存在場所を、CVとPVからの距離を測定して調べたところ、クラスターの約55%は、zone 1に、45%はzone 2に局在していた。しかしながら、zone 3にはクラスターは見られなかった(未発表データ)。一方、Gordon GJら(Gordon GJ 2000b)は、PH後14日目にクラスターを形成する細胞の90%以上がKi-67陽性であったと報告しているが、我々の実験では陽性を示す細胞は、SHPCsの20%未満であった(Ichinohe N 2017)。SHPCsの増殖活性は徐々に低下し、PH後30日目に肝重量はほぼ元に戻った(Gordon GJ 2000a)。TUNEL陽性を示す核は、Retで障害を受けたMHsや典型的にはSHPCクラスターを取り囲む巨細胞にしばしば認められたが、SHPCsにはほとんど認められなかった。Retで処理した肝臓におけるアポトーシスに陥った細胞数は、PH後1日でピークに達し(約6%)、その後減少する(Gordon GJ 2000c)。このモデルでは、OCsの増殖は中程度で、PH後7日でピークに達した(Gordon GJ 2000a)。OCsのbSHsへの分化はほとんど見られなかったことから、Retによる増殖抑制を受けたMHsの代わりに、SHPCsが増殖し拡大することによって、PHによって失われた肝臓の大きさを補っていると考えられる。その結果、正常ラットの肝臓では元の大きさを回復するのに7-10日かかるのに対し、Ret/PH処置を受けた肝臓では約1ヶ月かかる。
PH後早期に見られるSHPCsの形態的特徴は、大きさを除けばMHsのそれによく似ている(Gordon GJ 2000a)。SHPCsは、肝芽細胞、OCsおよびMHsと共通の表現型を持ち、MHsよりSHsに似ていると言える。一部のSHPCsは、PH後直ぐは、OC/BEC/肝芽細胞マーカー(OC.2およびOC.5)を発現している(Gordon GJ 2000b; 2000c)。初期のSHPCsにおける遺伝子とタンパク質の発現を解析したところ、肝臓に豊富に発現している主要な転写因子のすべて、WT1、AFP、P-糖タンパク質は発現していたが、TATとα1-antitrypsin (AAT)の発現は周囲のMHsに比べて低かった(Gordon GJ 2000c)。ラットの肝臓では、Cytochrome P450 (CYP) 2E1 と CYP3A1 は出生直前か出生時まで検出されないことが知られている (Hulla JE 1989; Omiecinski CJ 1990; Rich KJ 1997)。またラットにRetを投与すると肝臓でCyp2E1およびCyp3A1の発現が誘導されることがわかっている(Gordon GJ 2000d)が、PH後に出現するSHPCsでは欠失または有意に減少していた(Gordon GJ 2000c)。SHPCsの遺伝子発現を網羅的に解析すると、PH後14日目の肝臓ではCyp2b1を除き、分化機能に関連する多くの遺伝子がSHPCクラスター周囲のMHsのレベルに戻っている(Ichinohe N 2017)。CYPsはRetを代謝し毒性化合物に変化させるために必要であることから、CYPsの欠失または優位な減少によりSHPCsはRetを代謝できず、Retの細胞分裂抑制作用に対する抵抗性を獲得したと考えられる。SHPCsはMHsと比較して、多くのCYP遺伝子や分化機能関連遺伝子の発現が低下しているが、徐々に発現を回復することから(Kon J 2006; 2009; Ichinohe N 2017)、SHPCsは肝細胞に由来し、SHsに相当する細胞と考えられる。したがって、Gordonらが提唱するMHsとは異なる上皮系細胞は、Ret/PHで処理した肝小葉内には存在しないと考えられる(Gordon GJ 2000a)。
単離されたSHPCsがin vitroで増殖できるかどうかを調べることは重要である。Gordon GJらは、PH後6-8日目および13-15日目のRet/PH処理ラット肝臓から単離したSHPCsがin vitroで増殖もコロニー形成もしないことを報告している(Gordon GJ 2002)。我々も、Ret処理したラット肝臓からSHsを単離して増殖するかどうか調べた。Retを投与した肝臓からSHsを分離培養してもコロニーは形成されなかったが、Ret処理した肝臓にPHを行った直後の肝臓から分離した細胞を、MatやLNをコートしたディッシュ上に播種して培養すると、多くのSHコロニーが出現した(未発表データ)。この結果は、SHPCsがin vitroで増殖するためには、in vivoで増殖刺激に暴露されている必要があることを示している。
[4] Appearance of intermediate cells in human liver
ヒトの肝臓に小型の肝細胞が現れることはよく知られている。この細胞はMHsと胆管上皮細胞の中間の形質を示す。世界中の肝臓研究者が参加したコンセンサス会議において、中間的な肝胆管細胞(intermediate hepatobiliary cells, IHCs)は、直径6 μm(normal CoH細胞、最小の胆管細胞のおおよその大きさ)より大きく、40 μm(典型的な肝細胞の大きさ)より小さく、他の特徴はMHsとBECsの両方の特徴を示すと定義された(Roskams TA 2004)。 IHCsは、炎症が中等度から重度の肝臓に多く見られる。壊死性肝炎や非アルコール性脂肪性肝炎(NASH)の進行期では、炎症がより重度に進行し肝細胞の壊死が拡大するにつれて、IHCsの数は徐々に増加していた(Roskams TA 2003; Lowes KN 1999; Libbrecht L 2000)。IHCsのマーカーとして最も広く用いられているのは、biliary型ケラチン(Krt7とKrt19)である。Krt7陽性の肝細胞は、肝細胞ロゼット様、さらには肝小葉全体に不均一に分布する単一細胞または小集団として認められる(Van Eyken P 1988; Weng HL 2015, Figure 2)。
Desmet VJは、IHCsの分化ステージがKrt7とKrt19の発現勾配によって区別できることを示した(Desmet VJ 2011, Figure 2&4);肝細胞への肝幹前駆細胞(Liver stem/progenitor cells, LSPCs)の分化は、Krt19陽性LSPCsから、Krt19-Krt7+ IHCs、そして最終的にKrt7陰性肝細胞(ductular hepatopoiesis)へと進行する。対照的に、MHsの脱分化は、Krt7-肝細胞からKrt7+ IHCsを経て、最終的にKrt19+Krt7- DRsへと進行する(Weng HL 2015, Figure 2&4参照)。形態学的、表現型的な違いは顕著であるが、げっ歯類のOCsとヒトのIHCsは重要な生理的役割を共有している。これらの細胞は、胆管細胞抗原(Krt19、Krt7、OV-6)と肝細胞抗原(HepPar1、Albumin、α1-AT、時にAFP)を同時に発現する(Roskams TA 2004)。
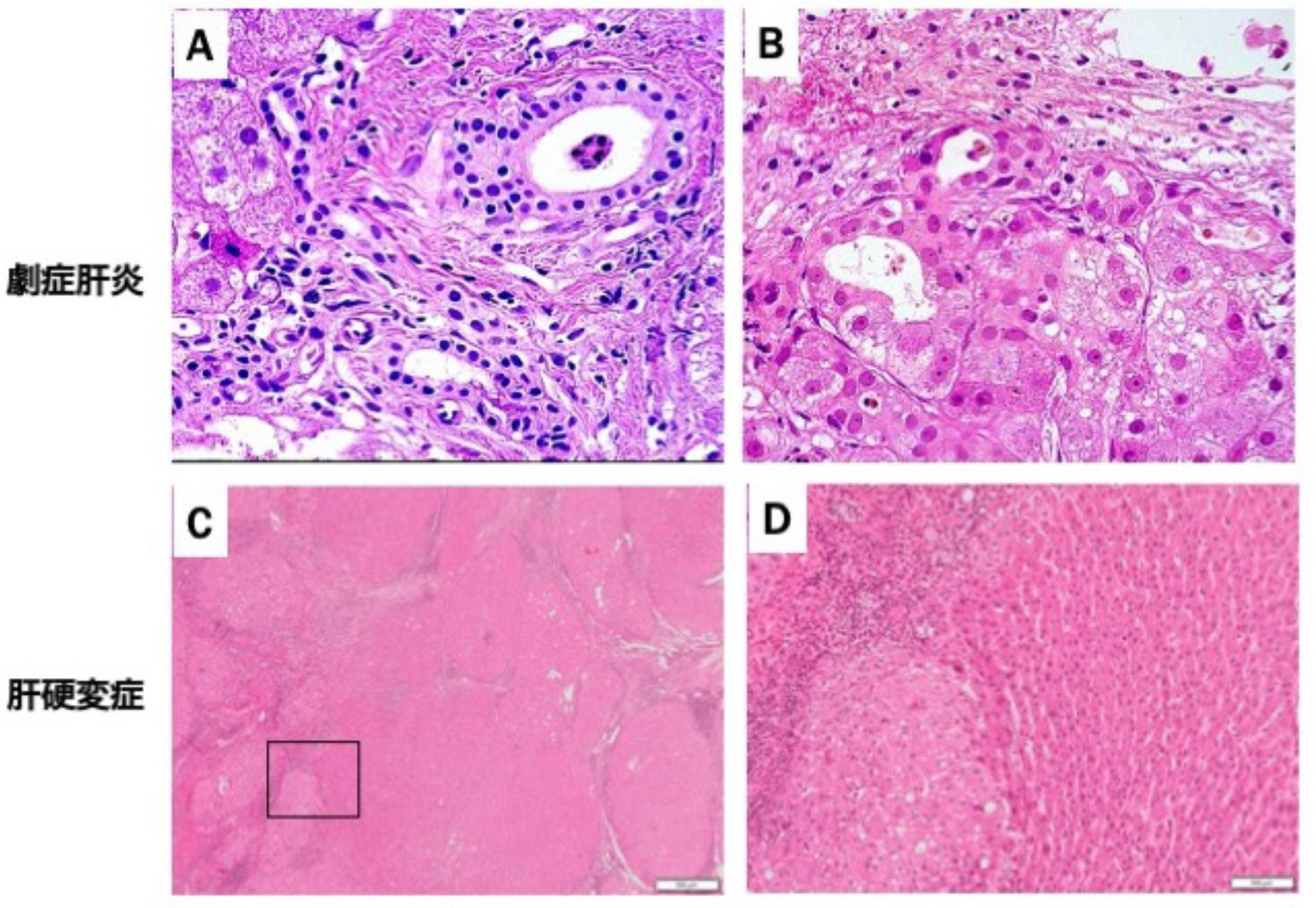
図8 ヒト肝臓に見られる小型肝細胞(SHs)。(A、B) 劇症肝炎からの回復期の肝組織(HE染色)。細胆管(Ductular reaction)の増生が著明である(A)。胆管細胞とSHsからなる胆管やSHsの小集塊が見られる(B)。(C、D) ヒト肝硬変症の組織像(HE染色)。多数の線維に囲まれた再生結節が見られる(C)。Dは、黒四角で囲まれた部分の拡大図である。残存肝細胞と比較して再生結節は、小型な肝細胞で構成されていることが判る。(C,D;旭川医科大学 西川 裕司学長より供与)
劇症肝不全(Acute liver failure, ALF)に伴う大量肝壊死(Massive hepatic necrosis, MHN)は稀ではあるが、様々な病因により起こり非常に重篤な合併症である(Weng HL 2015)。この病態はしばしば患者を死に至らしめるが、10-20%は肝移植を行わなくても自然に回復することが知られている。ALFにおけるMHNは、急速な肝細胞死と再生を含むユニークな病態生理学的特徴を示す。ALFでは、最初の再生反応は主に生き残った肝細胞によってもたらされる。障害が持続するか、大部分の肝細胞が障害されると、肝細胞の大量喪失を補うためにLSPCs が強力に増殖し始める(図8A, B)(Leftkowitch JH 2016)。最も一般的に認識されている組織反応はDRsの出現であり、これはヒト肝臓におけるLSPCsの存在を裏付けている。急性あるいは亜急性の肝障害におけるLSPCsの活性化の程度は、病理組織学的重症度や臨床的重症度と相関している(Katoonizadeh A 2006)。肝細胞喪失がより大きい領域では、肝細胞喪失がそれほど大きくない領域よりも、LSPCs の活性化と肝細胞分化が顕著であった。LSPCsの広範な活性化には、肝細胞の50%喪失(残存肝細胞の増殖能の著しい低下)が必要という閾値が存在する。この所見は、2-AAF処理後のラットOCsの用量依存的分化と類似している(Paku S 2004)。したがって、生存患者ではIHsはすでにMHsに完全に分化していたが、死亡患者ではこの分化過程(LSPCs-IHs-MHs)が阻害されていたと考えられる(Katoonizadeh A 2006)。
IHsを介したLSPCsからMHsへの分化過程は、補助的部分的同所性肝移植(Auxiliary partial orthotopic liver transplantation , APOLT)を受けた患者の肝臓で明瞭に認められる(Fujita M 2000)。APOLTの特徴は、生命維持が不可能なほどの重篤な損傷を受けても、損傷を受けた肝臓をその場に残して肝再生を可能にすることである(Chenard-Neu MP 1996)。損傷を受けた肝臓では、DRs(LSPCs)の活性化が観察された。DRsは常にperiportal領域から出現し、小葉内に伸長している。その強度は肝細胞損傷の程度と相関していた。DRsは胆管細胞マーカー(Krt7/19)と肝細胞マーカー(HepPar1、AAT、HNF4α)の両方を持つ中間的な細胞型を示すことから、DRsはLSPCsから発生した細胞集団であり、肝再生に重要な役割を果たしていると考えられた。この考え方は、APOLTを受けた患者の肝臓から連続生検によって得られた組織所見からも支持されている(Fujita M 2000)。DRsの出現量は徐々に増加し、その後、肝細胞様細胞の円形のクラスターが形成され、最終的に肝細胞の索状構造が再構築された。Quaglia Aらは、広範な肝障害を伴うALFのためにAPOLTを受けた患者では、移植後数日以内に残存肝で肝細胞増殖が起こることを報告している (Quaglia A 2008)。残存肝の障害部が地図状である場合、再生には様々な程度の肝細胞増殖と潜在的なductular hepatopoiesisが関与していることを示唆している。これらの結果は、移植した肝臓によって肝機能が十分にサポートされれば、LSPCsが増殖し、MHsに分化して、失われた肝細胞を補填できることを示している。LSPCsやDRsの活性化は、ヒトの慢性肝疾患でも観察される。肝細胞とBECsの特徴を共有する細胞がDRsに出現し、この細胞は「ductular hepatocytes(DHs)」と呼ばれる(Gerber MA 1983; Sirica AE 1995; Roskams TA 1998a)。この管様構造物は、一端が胆管細胞様、他端が肝細胞様の外観を示すことが多く、その細胞は形態学的、免疫組織化学的に様々な中間的表現型を示す(Roskams TA 1998b; Van Eyken P 1993)。それ故、DHsはCoHから発生すると考えられている(Theise ND 1999)。
一般的にLSPCsが活性化する引き金となるのは、ラット・マウスの実験モデルで見られるように、MHsが機能しなくなる場合である。ヒトの様々な慢性肝疾患における肝硬変期では、テロメア短縮による細胞老化によってMHsの増殖能が失われる。MHsの細胞老化は、慢性肝疾患の20〜30年の間に頻回に起こった細胞分裂の結果であると考えられる(Wiemann SU 2002; Marshall A 2005)。肝硬変では、再生結節全体がIHsで構成されていることがよく知られており、IHsはクローン性であり(Aihara T 1994)、LSPCsに由来すると考えられている(Roskams TA 2003)。しかしながら私は、肝細胞中のMH-I(SHs)が増生し、細胞老化に達したMH-IIIに代わって失われた肝細胞を補填していると考えている(図8C,D)。慢性肝炎後期の線維化が顕著になる前の小葉内によく見られる所見は、図9で見られるような広範なSHsの増生像である。肝再生結節を構成する細胞の由来は、LSPCsの可能性もあるが、多くはMH-I由来と考えて矛盾しない。したがって、これらの結果は、様々な疾患により重篤な損傷を受けた肝臓の再生過程において、IHCs、IHsあるいはDHsと呼ばれる小型肝細胞(SHs)の出現が、常に認められることを示している。
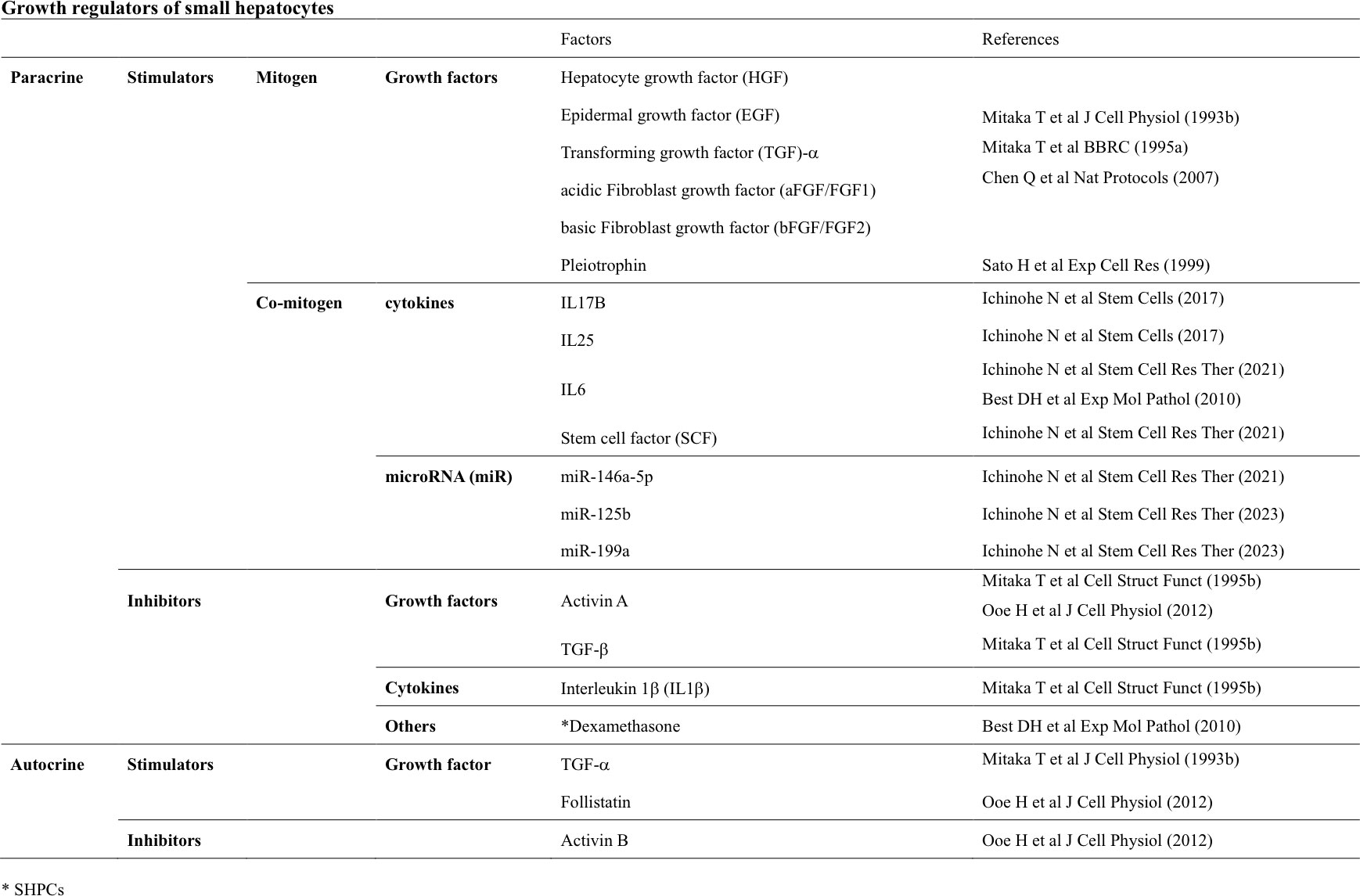
6. 小型肝細胞の増殖制御
SHsの増殖は様々な因子によって制御されていることが知られている(表1)。ラット初代培養においてSHsのコロニー形成を誘導するには、EGF、HGF、及びTransforming growth factor (TGF)-αのような増殖因子が必要である(Mitaka T 1993b; 1995a)。EGF、HGF及びTGF-αのSHコロニー誘導能に差異はなく、それぞれを組み合わせてもSHsの出現率に違いはなく、SHsの増殖に相乗的に作用することもなかった。FGFsはSHsのコロニー形成を誘導することはできたが、コロニー形成効率はEGF、HGF、TGF-α に比べて明らかに低かった(Miaka T 1993b)。SHsを増殖させコロニーを拡大させるには、培養当初はそれらの増殖因子を継続的に添加する必要があるが、その後、増殖因子を添加せずとも増殖可能になる。自らTGF-αを産生するためと考えられるが、増殖速度は添加した場合より遅くなる。
初代肝細胞の増殖に影響を与える薬剤は2つのグループに分類される(Michalopoulos GK 1990)。一つは、化学的に合成された物質のみからなる無血清培養液において、それ自体でDNA合成と細胞分裂を誘導できるcomplete mitogenである。もう一つは、complete mitogenと共存して肝細胞増殖を促進するco-mitogenである(表1)。Complete mitogensにはEGF、HGF、TGF-α、FGFsなどがある。
Co-mitogensには、tumor necrosis factor(TNF)-α、insulin-like growth factor(IGF)-I、norepinephrine、angiotensin-II、vasopressinなどがある(Michalopoulos GK 1990)。上述したように、complete mitogensは、SHsの出現と増殖を誘導する能力を有するが、co-mitogensはそれ自体ではSHsの出現を誘導できない。しかしながら、それらはSHsの増殖を促進し、コロニーを拡大させることができる(Mitaka T 1993b)。IL-6は初代ラット肝細胞の増殖を抑制したが(Mitaka T 1993b)、IL-6とstem cell factor(SCF)はEGFを含む培地中でSHsのコロニー形成を促進し、IL-6とSCFを組み合わせると、SHコロニーの数と大きさを有意に増加させた(Ichinohe N 2021)。
一方、Ret/PH処理ラットの肝臓では、PHの前にDexamethasone(Dex)を投与するとSHPCクラスターの出現が阻害され肝再生が抑制されるため、ラットの早期死亡率が著しく上昇する(Best DH 2010)。しかし、Dexを投与したRet/PHラットにIL-6を投与すると、肝再生は回復し死亡率は減少した。IL-6を投与しなかった肝臓に比べて、投与した肝臓では、拡大したSHPCクラスター数が増えていた。Dex投与は、TNF-αとIL-6のそれぞれの遺伝子の転写を阻害し、その産生を抑制することを考慮すると(Ledda-Columbano GM 1994; Kubo Y 1996; Nagy P 1998)、これらの結果は、Ret/PH処理したラット肝臓におけるSHPCsの出現にはサイトカインのプライミングが必要であり、IL-6がSHPCsの活性化を直接制御していることを示している(Best DH 2010)。Dexの効果はin vivoでは確認できるが、初代肝細胞が生存し維持されるためには、培養液へのinsulinとDexの添加が必須である(Mitaka T 1998)。それ故、SHs のコロニー形成に対するDexの効果をin vitroで評価するのは難しいかもしれない。
正常肝臓において、Activin (Act)/Follistatin (Fst)系が細胞増殖の恒常性に重要な役割を果たしていることはよく知られている(Hully JR 1994; Kogure K 2000; Ichikawa T 2001; Takabe K 2003)。正常肝臓では、MHsはActAを恒常的に産生し、autocrine/paracrineで肝細胞増殖抑制因子として働いている(Yasuda H 1993)。また、ActAの発現は老化したラット肝臓で増加することが報告されている(Mitaka T 2023)。我々は、SHs が培養液中にActBとFstを分泌し、SHsの増殖に伴って両者の分泌が増加することを報告した(Ooe H 2012)。Actの生理活性は、細胞外結合タンパク質であるFstと結合すると、その活性が強く阻害される(Rodgarkia-Dara C 2006)。したがって、PH後にFstを投与すると、Actの作用が阻害され、結果として肝再生が促進される(Kogure K 1995)。一方、Fstの発現はSHsの増殖に重要であり、分泌されたFstはおそらく自ら産生するActBの増殖抑制作用を阻害することで増殖が促進されているのだろう(Ooe H 2012)。ActAまたはActBを培養液に投与しても、SHsにFstの発現を誘導できなかった。また、SHsが培養経過に伴って自然に成熟化するとFstの発現が低下する一方、ActAが発現し、SHsの増殖が抑制された。ActBはActAと同様の生理活性を示すが、活性はActAより低いことが知られている(Schnever A 2003)。我々もまた、ActBのSH増殖抑制作用は、ActAよりも弱いことを確認している(Ooe H 2012)。加えて、ActA投与はMHsのアポトーシスを誘導する(Hully JR 1994; Schwall RH 1993)。ActAとActBは、SHsの増殖を強く抑制したが、SHsのアポトーシスは誘導できなかった(Ooe H 2012)。この相違は、MHsとSHsのActシグナル伝達経路の違いから生じているのかもしれない。またCD44陽性癌幹細胞はアポトーシスシグナルに抵抗性であり(Chikamatsu K 2012; Zöller M 2011)、OCsやLSPCsは、TGFβ誘導性アポトーシスに抵抗性であることが報告されている(Clark JB 2005; Ding W 2009)。SmadはTGFβ/Actシグナリングの必須分子である。Smad6の発現はSHsとMHsで差はなかったが、Smad7の発現はMHsよりSHsの方が明らかに高かった(Ooe H 2012)。SHsにおけるCD44とSmad7の発現が、Act誘導性アポトーシスに対する抵抗性を誘導しているかもしれない。
我々は、Ret/PH処理ラット肝臓への細胞移植が、SHPCsの増殖に影響を与える場合があることを報告している(Ichinohe N 2017; 2019; 2023)。GalN処理ラット肝臓から分離したThy1陽性間葉系細胞(hepatic Thy1)やラット骨髄由来間葉系細胞(Bone marrow-derived mesenchymal cells, BM-MCs)をRet/PH処理ラット肝臓に脾臓経由で移植すると、recipient肝臓の再生を刺激し肝臓が肥大する。組織学的な解析から、hepatic Thy1を移植した肝臓では、SHPCクラスターの数と大きさがコントロールラットの肝臓よりも有意に大きいことが明らかになった(Ichinohe N 2017)。hepatic Thy1には線維芽細胞様間葉系細胞(Thy1-MCs)と上皮様細胞の2種類の細胞が含まれており、SHPCsの増殖を促進するのは前者のThy1-MCsのみであり、後者はSHsに分化可能なLSPCsを含んでいる(Ichinohe N 2017)。一方、健康なラットの骨髄から分離したBM-MCsもまた、SHPCsの増殖を促進した(Ichinohe N 2021)。ほとんどのThy1陽性ドナー細胞は生着せず、レシピエントの肝臓に留まるのはごく少数であるにもかかわらず、SHPCクラスターの拡大は1ヶ月以上持続した。我々は、肝類洞内に短期間留まるドナー細胞が細胞外小胞(extracellular vesicles, EVs)を分泌し、それが近隣の肝細胞に影響を及ぼすのではないかと推測した。実際、培養したThy1-MCから採取したEVsをRet/PH処理した肝臓に 脾臓経由で投与したところ、SHPCクラスターの拡大を誘導できた(Ichinohe N 2021; 2023)。しかし、hepatic Thy1が産生するEVsの標的細胞は、BM-MCsによるEVsの標的細胞とは明らかに異なっていた。
SHPCsの網羅的遺伝子解析の結果、hepatic Thy1を移植すると、SHPCsはIl17rbだけでなく、Il6rとEgfrの発現も増加させることが分かった(Ichinohe N 2017)。IL17RB のリガンドであるIl17bの発現は、Ret/PH処置肝臓から単離されたSECsで増加していたのに対し、Il25はKupffer cells (KCs)で高かった。一方、正常な肝臓から分離したSECsとKCsは、Il17bとIl25を発現していなかった。hepatic Thy1-EVsは、培養SHsのIl17rb遺伝子発現を増強し、SHsの増殖はIL17BとIL25の投与によって促進されたが、IL17BとIL25の相乗効果は認められなかった(Ichinohe N 2017)。さらに、移植したhepatic Thy1によって活性化されたKCsは、cytokine-induced neutrophil chmoattractant-2(CINC-2)とmiR-199a-5pを産生し、CINC-2はSECsのIl17b発現を促進した。さらに、CINC-2にSHsの増殖促進作用はなかったが、CINC-2で処理したSECsの培養上清はSHsの増殖を促進した(Ichinohe N 2023)。抗IL17B抗体やCXCR2インヒビターを投与するとSHsに対する増殖促進作用が抑制されることから、IL17RBおよびCXCR2シグナルがSHsの増殖に関与している事が分かった。これらの結果は、hepatic Thy1をRet/PH処置肝臓に移植すると、ドナー細胞が産生するEVsによりIL17RBシグナル経路を介してSHPCsの増殖が促進される一方、miR-199a-5pはSHPCsに直接作用して増殖促進に働いている可能性を示している。また、BM-MC-EVsの網羅的遺伝子解析とサイトカイン解析の結果から、BM-MC-EVsに含まれるmiR-146a-5p、IL6、SCFが、SHsの増殖を促進することが分かった(Ichinohe N 2021)。
塩化ガドリニウム(Gadolinium chloride, GdCl3)はKCsの貪食機能を抑制することが知られている。PHの24時間前にGdCl3を投与したRet/PH処置ラットに、hepatic Thy1を移植すると、SHPCクラスターの拡大はほとんど認められなかったが、BM-MCsを移植した肝臓では、SHPCクラスターの数と大きさが有意に増加した(Ichinohe N 2021)。BM-MCsまたはhepatic Thy1のいずれかを移植した肝臓のSHPCsにおいて、Il17rbの発現は、コントロールと比較してより増強されたが、hepatic Thy1を移植した肝臓におけるSHPCsで、その発現はより高かった。これらの結果は、hepatic Thy1移植によるSHPCsの増殖は、KCsの貪食活性に依存し、KCsを介するIL17RBシグナルに依っていることを示唆している。つまり、hepatic Thy1を移植した肝臓では、KCsの不活性化によりIL25、CINC-2とmiR-199aの分泌が抑制され、IL25とmiR-199a によるSHPCsへの増殖刺激とSECsを介したIL17Bの分泌が減少することにより、SHPCsへのIL17RBシグナルを介した増殖刺激が失われた。一方、BM-MCsを移植した肝臓では、KCsの不活性化により、KCsによる貪食から逃れたドナー細胞が類洞に比較的長く滞留するようになる。その結果、ドナー細胞からのEVsとサイトカインの両方の分泌が増加し、隣接細胞への作用が増強されたと考えられる(Ichinohe N 2021)。実際、hepatic Thy1を移植したラットの肝臓では、約10%のSHPCクラスターはzone 3に認められた(未発表データ)が、hepatic Thy1-EVを投与した肝臓では、zone 3にSHPCクラスターを認めなかった。対照的に、BM-MCs移植またはBM-MC-EV投与した肝臓では、SHPCクラスターの分布に影響はなく、zone 3にはほとんど認められなかった。
7. 肝再生過程におけるSHsの役割
SHsに関するこれまでに得られた知見を考慮すると、肝再生におけるSHsの関与は以下のようにまとめられる;
1) Simple loss of MHs
2/3PHを行った場合、残存肝細胞はほぼ無傷であり、残った肝細胞の分裂によって失われた細胞数を回復することができる。四塩化炭素 (CCl4)を投与した時も、2/3PHと同様の様式で肝再生が起こる。どちらの場合も、残存するほとんどの肝細胞がDNA合成を行うので、MH-IとMH-IIの両方が均等に、元の肝臓の体積が回復するまで分裂する。したがって、肝幹細胞は、この再生過程には寄与せず、MH-Iのクローン性増殖(SHsのクラスター)は認められない。
2) Growth suppression of MHs
肝細胞の増殖能が抑制されたり、恒常性を維持するために必要な機能を発揮できる肝細胞の数が圧倒的に少なかったりすると、肝再生の過程は、単純な肝細胞の消失とは明らかに異なるものとなる。MHsの増殖が抑制されるパターンは3つ考えられる:
(2-1)MH-IIの増殖は抑制されるがMH-Iの増殖は抑制されない場合
(2-2)MH-IとMH-IIのどちらの細胞分裂も抑制される場合
(2-3)その中間的な状態が見られる場合。LSPCsの出現時期は、肝細胞への増殖抑制の強さに依存すると考えられる。
(2−1)Retの場合、先に記述したようにMH-IIはRetに感受性であるが、MH-Iは抵抗性である。RetはMH-IIの増殖を抑制するが、その分化機能には影響を与えない。そのため、Retを投与したラットに2/3PHを行っても、基本的な肝機能は残存細胞によって維持可能である。残存肝が元の体積を回復するために、MH-IIに代わってMH-Iが活発に増殖し、その結果SHPCクラスターが出現する。Retを投与した動物では、無処置の動物に比べて元の体積を回復するのに時間がかかるが、OCsを誘導して新生肝細胞を創生する必要は少ない。
(2−2) 2-AAFを用いると、2/3PH後の肝細胞の増殖が完全に抑制されることはよく知られている。このことはMH-IとMH-IIの両方が増殖できず、残存する肝細胞の増殖による失われた細胞の補填が困難であることを意味する。低用量の2−AAFを投与したラットでは、低下した肝機能を早急に回復させるために、肝幹細胞への強い増殖刺激がかかりOCsが動員され、その後肝細胞分化が誘導される。増加したOval細胞は小さな管腔を作るように配列しGlisson鞘域から小葉内に向かって伸展し、そして管腔の遠位部(小葉側)の細胞はSHs(ductal hepatocytes)に分化する。高用量の2-AAFを投与した肝臓では、DRsとは別に、小葉内にSHsからなる細胞集塊が出現する。
(2−3) GalNを投与すると、Retや2-AAFを投与したときとは異なる反応が起こる。中心静脈周囲の肝細胞は死滅するが、生き残った肝細胞も程度の差はあれ損傷を受ける。従って、肝細胞損傷後の増殖刺激は最初に胆管(CoHも含む)に加わり、その結果、小胆管を由来のOCs(Thy1+/Krt19+/CD44-細胞)が出現する。MH-Iの増殖抑制はMH-IIのそれよりも弱いため、増殖刺激に対するMH-Iの反応は、OCsから少し遅れて起こり、CD44陽性肝細胞になる。実際、GalN処理後3日前後で、Thy1+/CD44+細胞が門脈周囲領域に出現するのに対し、MH-I由来のSHsはThy1+/CD44+細胞と残存肝細胞の境界領域に多数出現する。つまり、Thy1+/CD44+細胞に隣接する門脈周囲領域では、OCs由来のSHs(Thy1+/CD44+)とMH-I由来のSHs(Thy1-/CD44+)が一時的に混在していることになる。そのため、MH-IIの増殖とMH-I由来の新生肝細胞の両者によって肝細胞数が回復すると、OCsからなる小胆管が退縮する。そして肝再生は完了すると考えられる。
3) Exhaustion of Growth capability of MHs
加齢に伴い、MH-IIは細胞老化に達し、多くのMH-IIがMH-IIIとなる。それに伴いMH-Iの数は減少する。老齢ラット肝では、ActAの発現亢進によりMHsの増殖が抑制されるため、死んでいくMH-IIIをMH-IIの増殖によって補うことが出来なくなる。そのため、MH-I(SHs)が活性化され、SHsの小集塊が形成されると考えられる。ヒトを含む老齢動物の肝臓を外科的に切除すると、若い動物に比べ、元の大きさに回復するのに時間がかかる。一方、ヒトの慢性肝疾患の肝硬変期では、テロメア短縮による細胞老化により、生存肝細胞の増殖能が失われることが知られている。肝細胞の細胞老化は、慢性肝疾患患者では、20〜30年に渡る継続的な増殖刺激により肝細胞分裂が続いた結果引き起こされる。したがって、肝硬変肝では、再生結節全体がSHsで構成されていることが多い。
4) Massive loss of MHs
ALF患者では、多くの肝細胞が失われている。最初に起こる再生反応は、主に生き残った肝細胞によってもたらされると考えられている。ほとんどの肝細胞が失われた場合、APOLTのような十分な肝機能補助療法が行われれば、残存肝においてIHsが著しく増加することが分かっている。このことは、DRsからIHsを介するMHsへの分化が、障害された肝臓で起こっていることを示している。
8. 結語
これまで述べてきたように、SHsは肝機能が恒常性を維持するのに十分でない場合の肝再生過程で出現する。肝細胞数または肝機能が正常な状態に回復するまでは、SHsは出現し続けるが、細胞形態からSHとして識別できるのは短期間で、多くはすぐにMHsに分化する。しかし、SHsは単一な集団ではなく、MH由来(MH-SHs)とOC由来(OC-SHs)という2つの異なる起源を持つ細胞が混在している。どちらのSHsも、典型的なMHsよりサイズが小さく、MHsに比較して分化度が低いという特徴を持っていることは基本的に共通しているが、以下に挙げるいくつかの違いがある:
- MH-SHsは、肝障害後に比較的多くのMHsが残存しているときに出現する。
- 多くのMHsが傷害されると残存するMHsだけではなくOCsも活性化され、OC-SHsとMH-SHsの両方が小葉内に一過性に共存するが、MH-SHsが主として肝細胞数の回復に寄与する。ほとんどのOC-SHsはアポトーシスにより消滅する。
- MH-SHsの大きさはOC-SHsより比較的大きく、且つMH-SHsはOC-SHsより分化している。
- 4OC-SHsはBECsに分化しやすいが、MH-SHsはBECsに分化しにくい。
- 大部分のMHs が損傷を受けると、OCsが強く活性化されてOC-SHsが出現し、肝小葉の大部分はOC由来のMHsで占められる。しかし、生き残ったMHsがMH-SHsを介して徐々に増殖し、肝臓が十分な機能や元の体積を回復すると、OCs由来のMHsは徐々に排除され、最終的には既存MH由来の細胞に置き換わる。
- 肝臓に移植されたMH-SHsは、OC-SHsよりも容易に肝細胞索に挿入される。
私はin vitroおよびin vivoで "small hepatocytes "を研究してきたが、MHsからSHsへの移行はどのようなシグナルが引き金になるのか、どのような分子機構が関与しているのか、なぜSHsではCD44が発現するのか、など、解明すべき未解決の問題は山積している。残された課題を解明するためには、さらなる研究が必要であるが時間切れである。この総説は、英文で書いたReview (Mitaka T 2023)を下敷きに書いたものである。
謝辞
米国留学時代に『小型肝細胞』を見出してから約35年間、小型肝細胞の魅力に取り憑かれて研究をしてきました。1つのテーマで研究者人生を全うできたことは研究者冥利に尽きます。私がこれまで研究を続けてこられたのは、教室に来て一緒に研究をしてくださった若い先生方が出した成果を学会発表や論文の形にして世に出し、評価や批判を受けながら、一歩ずつ小型肝細胞の肝発生・再生における役割を明らかにしてきました。日本では肝細胞研究会だけが、私達の研究を理解し批判してくださる場でした。研究会の会員の皆様には唯々感謝しかありません。
本総説は、これまで多くの研究者が報告してきた現象を俯瞰して、小型肝細胞はどのような場面で出現し、どのような役割をしているのか、私なりに考えたことを文にしたものです。当然、様々なご意見はあると思いますが、皆様の研究の一助になりましたら幸甚です。また、若いこれからの研究者が、斬新なアイデアで新たな概念を打ち立てるための礎に少しでもなれましたら、これに勝る慶びはありません。
本総説の執筆にあたり、市戸義久先生と谷水直樹先生には、教室で一緒に研究を進める中で、実験データの解析や解釈で数え切れないほどディスカッションをし、考えを修正してきました。また本文の校閲もして頂きました。肝炎、肝硬変症の病理標本の写真は旭川医科大学学長である西川祐司先生に快く提供していただきました。心より感謝申し上げます。
Abbreviations
| 2-AAF | 2-acetylaminofluorene |
|---|---|
| Act | activin |
| Alb-uPA | albumin-urokinase-type plasminogen activator |
| ALF | acute liver failure |
| AFP | α-fetoprotein |
| APOLT | Auxiliary partial orthotopic liver transplantation |
| AAT | α1-antitrypsin |
| β-gal | β-galactosidase |
| bSHs | basophilic SHs |
| BCs | bile canaliculi |
| BDs | bile ducts |
| BECs | biliary epithelial cells |
| BM-MCs | bone marrow-derived mesenchymal cells |
| CINC-2 | cytokine-induced neutrophil chemoattractant-2 |
| CoH | Canal of Hering |
| Col | collagen |
| C/EBP | CCAAT/enhancer binding protein |
| Cx | connexin |
| CYP | cytochrome P450 |
| Dex | dexamethasone |
| DHs | ductular hepatocytes |
| Dlk-1 | protein delta homolog 1/preadipocyte factor 1 |
| DMSO | dimethylsulfoxide |
| DRs | ductular reactions |
| ECMs | extracellular matrices |
| EGF | epidermal growth factor |
| EHS | Engelbreth-Holm-Swam |
| EVs | extracellular vesicles |
| EpCAM | epithelial cell adhesion molecule |
| FAH | fumarylacetoacetate hydrolase |
| FGF | fibroblast growth factor |
| Fst | follistatin |
| GalN | D-galactosamine |
| GdCl3 | gadolinium chloride |
| GST-P | glutathione-S-transferase placental type |
| HA | hyaluronic acid |
| HGF | hepatocyte growth factor |
| HiPSCs | human induced pluripotent stem cells |
| HNF | hepatocyte nuclear factor |
| HPPCs | hepatocytic parental progenitor cells |
| HPPLs | hepatic progenitor cells proliferating on LN |
| HSCs | hematopoietic stem cells |
| ICAM | intercellular cell adhesion molecule |
| IGF | insulin-like growth factor |
| IHs | intermediate hepatocytes |
| IHCs | intermediate hepatobiliary cells |
| iPSCs | induced pluripotent stem cells |
| KCs | Kupffer cells |
| Krt | keratin |
| LECs | liver epithelial cells |
| LGR | leucine-rich orphan G-protein-coupled receptor |
| LN | laminin |
| LSPCs | hepatic stem/progenitor cells |
| MHN | massive hepatic necrosis |
| MHs | mature hepatocytes |
| MUP-uPA | major urinary protein-urokinase-type plasminogen activator |
| NPCs | non-parenchymal cells |
| OCs | oval cells |
| OTC | ornithine transcarbamylase |
| PH | partial hepatectomy |
| Ret | retrorsine |
| SCF | stem cell factor |
| SECs | sinusoidal endothelial cells |
| SHs | small hepatocytes |
| SHPCs | small hepatocyte-like progenitor cells |
| Tert | telomerase reverse transcriptase |
| TGF | transforming growth factor |
| TNF-α | tumor necrotic factor-α |
参考文献
- Aihara T, Noguchi S, Sasaki Y, Nakano H, Imaoka S. (1994) Clonal analysis of regenerative nodules in hepatitis C virus-induced liver cirrhosis. Gastroenterology. 107(6):1805-11. doi: 10.1016/0016-5085(94)90824-9.
- Alison MR, Golding M, Sarraf CE, Edwards RJ, Lalani EN. (1996) Liver damage in the rat induces hepatocyte stem cells from biliary epithelial cells. Gastroenterology 110: 1182-1190. https://doi.org/10.1053/gast.1996.v110.pm8613008
- Alison MR. (2003) Characterization of the differentiation capacity of rat-derived hepatic stem cells. Semin Liver Dis. 23(4):325-36. doi: 10.1055/s-2004-815561Arber N, Zajicek G, Ariel I. (1988) The streaming liver II. Hepatocyte life history. Liver 8, 80-87. doi: 10.1111/j.1600-0676.1988.tb00972.x
- Ang CH, Hsu SH, Guo F, Tan CT, Yu VC, Visvader JE, Chow PKH, Fu NY. (2019) Lgr5+ pericentral hepatocytes are self-maintained in normal liver regeneration and susceptible to hepatocarcinogenesis. Proc Natl Acad Sci USA 116(39):19530-19540. doi: 10.1073/pnas.1908099116.
- Arber N, Zajicek G, Ariel I. (1988) The streaming liver II. Hepatocyte life history. Liver 8, 80-87. doi: 10.1111/j.1600-0676.1988.tb00972.x
- Asahina K, Shiokawa M, Ueki T, Yamasaki C, Aratani A, Tateno C, Yoshhizato K. (2006) Multiplicative mononuclear small hepatocytes in adult rat liver: Their isolation as homogeneous population and localization to periportal zone. Biochem. Biophys. Res. Commun 342: 1160-1167. https://doi.org/10.1016/j.bbrc.2006.02.076.
- Bachmann W, Harms E, Hassels B, Henninger H, Reuitter W. (1977) Studies on rat liver plasma membrane, altered protein and phospholipid metabolism after injection of D-galactosamine. Biochem J 166: 455-462. doi: 10.1042/bj1660455.
- Baribault H, Leroux-Nicolet I, Marceau N. (1985) Differential responsiveness of cultured suckling and adult rat hepatocytes to growth-promoting factors: entry into S phase and mitosis. J Cell Physiol 122: 105-112. doi: 10.1002/jcp.1041290112.
- Best DH, Butz GM, Coleman WB. (2010) Cytokine-dependent activation of small hepatocyte-like progenitor cells in retrorsine-induced rat liver injury. Exp Mol Pathol 88(1): 7-14. doi: 10.1016/j.yexmp.2009.10.009.
- Bralet M-P, Branchereau S, Brechot C, Ferry N. (1994) Cell lineage study in the liver using retroviral mediated gene transfer: Evidence against the streaming of hepatocytes in normal liver. Am J Pathol. 144, 896-905.
- Braun KM, Sandgren EP. (2000) Cellular origin of regenerating parenchyma in a mouse model of severe hepatic injury. Am J Pathol. 157(2):561-9. doi: 10.1016/S0002-9440(10)64566-X
- Bucher NLR. (1963) Regeneration of mammalian liver. Int Rev Cytol 15: 245-300. doi: 10.1016/s0074-7696(08)61119-5
- Bucher NLR, Swaffield MN. (1964) The rate of incorporation of labeled thymidine into the deoxyribonucleic acid of regenerating rat liver in relation to the amount of liver excised. Cancer Res. 24:1611-25
- Bucher NLR, Malt RA. (1971) Regeneration of the Liver and Kidney. Boston: Little, Brown and Co.
- Chen Q, Kon J, Ooe H, Sasaki K, Mitaka T. (2007) Selective Proliferation of Rat Hepatocyte Progenitor Cells in Serum-free Culture. Nature Protocols, 2(5), 1197-1205 DOI: 10.1038/nprot.2007.118
- Chenard-Neu MP, Boudjema K, Bernuau J, Degott C, Belghiti J, Cherqui D, Costes V, Domergue J, Durand F, Erhard J, De Hemptinne B, Gubernatis G, Hadengue A, Kemnitz J, McCarthy M, Maschek H, Mentha G, Oldhafer K, Portmann B, Praet M, Ringers J, Rogiers X, Rubbia L, Schalm S, Kate FT, Terpstra O, Van Hoek B, Williams R, Zafrani E, Cinqualbre J, Wolf P, Jaeck D, Bellocq JP. (1996) Auxiliary liver transplantation: regeneration of the native liver and outcome in 30 patients with fulminant hepatic failure--a multicenter European study. Hepatology. 23(5): 1119-1127. doi: 10.1002/hep.510230528.
- Chikamatsu K, Ishii H, Takahashi G, Okamoto A, Moriyama M, Sakakura K, Masuyama K. (2012) Resistance to apoptosis-inducing stimuli in CD44+ head and neck squamous cell carcinoma cells. Head Neck 34(3): 336-343. doi: 10.1002/hed.21732.
- Clark JB, Rice L, Sadiq T, Brittain E, Song L, Wang J, Gerber DA. (2005) Hepatic progenitor cell resistance to TGF-beta1's proliferative and apoptotic effects. Biochem Biophys Res Commun 329(1): 337-344. doi: 10.1016/j.bbrc.2005.01.129.
- Dabeva MD, Shafritz DA. (1993) Activation, proliferation, and differentiation of progenitor cells into hepatocytes in the d-galactosamine model of liver regeneration. Am J Pathol 143: 1606-1620.
- Dabeva MD, Laconi E, Oren R, Petkov PM, Hurston E, Shafritz DA. (1998) Liver regeneration and a-fetoprotein messenger RNA expression in the retrorsine model for hepatocyte transplantation. Cancer Res, 58:5825-5834
- Dabeva MD, Shafritz DA. (2003) Hepatic stem cells and liver repopulation. Semin Liver Dis. 23(4):349-362. doi: 10.1055/s-2004-815562Decker K, Keppler D. (1974) Galactosamine hepatitis: key role of the nucleotide deficiency period in the pathogenesis of cell injury and cell death. Rev Physiol Biochem Pharmacol 71:78-106. doi: 10.1007/BFb0027661.
- DeBaun JR, Rowley JY, Miller EC, Miller JA. (1968) Sulfotransferase activation of N-hydroxy-2-acetylaminofluorene in rodent livers susceptible and resistant to this carcinogen. Proc Soc Exp Biol Med 129: 268-273. doi.org/10.3181/00379727-129-33301
- Decker K, Keppler D. (1974) Galactosamine hepatitis: key role of the nucleotide deficiency period in the pathogenesis of cell injury and cell death. Rev Physiol Biochem Pharmacol 71:78-106. doi: 10.1007/BFb0027661.
- DeMars R, LeVan SL, Trend BL, Russell LB. (1976) Abnormal ornithine carbamoyltransferase in mice having the sparse-fur mutation. Proc Natl Acad Sci U S A. 73(5):1693-7. doi: 10.1073/pnas.73.5.1693
- Desmet VJ. (2011) Ductal plates in hepatic ductular reactions. Hypothesis and implications. I. Types of ductular reaction reconsidered. Virchows Arch. 458(3):251-259. doi: 10.1007/s00428-011-1048-3.
- Dezsö K, Jelnes P, László V, Baghy K, Bödör C, Paku S, Tygstrup N, Bisgaard HC, Nagy P. (2007) Thy-1 is expressed in hepatic myofibroblasts and not oval cells in stem cell-mediated liver regeneration. Am J Pathol 171:1529-1537. doi: 10.2353/ajpath.2007.070273.
- Ding W, Mouzaki M, You H, Laird JC, Mato J, Lu SC, Rountree CB. (2009) CD133+ liver cancer stem cells from methionine adenosyl transferase 1A-deficient mice demonstrate resistance to transforming growth factor (TGF)-beta-induced apoptosis. Hepatology 49(4): 1277-1286. doi: 10.1002/hep.22743
- Dudas J, Mansuroglu T, Batusic D, Saile B, Ramadori G. (2007) Thy-1 is an in vivo and in vitro marker of liver myofibroblasts. Cell Tissue Res 329: 503-514. doi: 10.1007/s00441-007-0437-z.
- Duncan AW, Dorrell C, Grompe M. (2009) Stem cells and liver regeneration. Gastroenterology. 2009 Aug;137(2):466-81. doi: 10.1053/j.gastro.2009.05.044.
- Evarts RP, Nagy P, Marsden E, Thorgeirsson SS. (1987) In situ hybridization studies on expression of albumin and -feto-protein during the early stage of neoplastic transformation in rat liver. Cancer Res 47:5469-5475
- Fabrikant JI. (1968) The kinetics of cellular proliferation in regenerating liver. J Cell Biol. 36(3):551-65. doi: 10.1083/jcb.36.3.551
- Farber E. (1956) Similarities in the sequence of early histological changes induced in the liver of the rat by ethionine, 2-acetylaminofluorene, and 3'-methy-4-dimethylaminoazobenzene. Cancer Res 16:142-149
- Fausto N. (2004) Liver regeneration and repair: hepatocytes, progenitor cells, and stem cells. Hepatology 39: 1477-1487. doi: 10.1002/hep.20214.
- Fausto N, Campbell JS, Riehle KJ. (2006) Liver regeneration. Hepatology. 43(2 Suppl 1): S45-53. doi: 10.1002/hep.20969
- Fiegel HC, Park JJ, Lioznov MV, Martin A, Jaeschke-Melli S, Kaufmann PM, Fehse B, Zander AR, Kluth D. (2003) Characterization of cell types during rat liver development. Hepatology. 2003 Jan;37(1):148-54. doi: 10.1053/jhep.2003.50007
- Font-Burgada J, Shalapour S, Ramaswamy S, Hsueh B, Rossell D, Umemura A, Taniguchi K, Nakagawa H, Valasek MA, Ye L, Kopp JL, Sander M, Carter H, Deisseroth K, Verma IM, Karin M. (2015) Hybrid Periportal Hepatocytes Regenerate the Injured Liver without Giving Rise to Cancer. Cell. 162(4):766-79. doi: 10.1016/j.cell.2015.07.026
- Forbes SJ, Vig P, Poulsom R, Thomas H, Alison M. (2002) Hepatic stem cells: J Pathol 197:510-518. doi: 10.1002/path.1163.
- Fujita M, Furukawa H, Hattori M, Todo S, Ishida Y, Nagashima K. (2000) Sequential observation of liver cell regeneration after massive hepatic necrosis in auxiliary partial orthotopic liver transplantation. Mod Pathol 13(2): 152-157. doi: 10.1038/modpathol.3880029
- Gadd VL, Aleksieva N, Forbes SJ. (2020) Epithelial plasticity during liver injury and regeneration. Cell Stem Cell 27: 557-573. https://doi.org/10.1016/j.stem.2020.08.016.
- Gerber MA, Thung SN, Shen S, Stormeyer FW, Ishak K. (1983) Phenotypic characterization of hepatic proliferation: Antigenic expression by proliferating epithelial cells in fetal liver, massive hepatic necrosis, and nodular transformation of the liver. Am J Pathol 110: 70-74.
- Goodison S, Urquidi V, Tarin D. (1999) CD44 cell adhesion molecules. Mol Pathol. 52(4): 189-96. doi: 10.1136/mp.52.4.189.
- Gordon GJ, Coleman WB, Hixson DC, Grisham JW. (2000a). Liver regeneration in rats with retrorsine-induced hepatocellular injury proceeds through a novel cellular response. Am. J. Pathol. 156, 607-619. doi: 10.1016/S0002-9440(10)64765-7.
- Gordon GJ, Coleman WB, Grisham JW. (2000b). Bax-Mediated Apoptotis in the Livers of Rats After Partial Hepatectomy in the Retrorsine Model of Hepatocellular Injury. Hepatology 32: 312-320. doi: 10.1053/jhep.2000.9144.
- Gordon GJ, Coleman WB, Grisham JW. (2000c). Temporal analysis of hepatocyte differentiation by small hepatocyte-like progenitor cells during liver regeneration in retrorsine-exposed rats. Am J Pathol 157: 771-786. doi: 10.1016/S0002-9440(10)64591-9.
- Gordon GJ, Coleman WB, Grisham JW. (2000d). Induction of cytochrome P450 enzymes in the livers of rats treated with the pyrrolizidine alkaloid retrorsine. Exp Mol Pathol 69: 17-26. doi: 10.1006/exmp.2000.2308
- Gordon GJ, Butz GM, Grisham JW, Coleman WB. (2002) Isolation, short-term culture, and transplantation of small hepatocyte-like progenitor cells from retrorsine-exposed rats. Transplantation 73(8): 1236-1243. doi: 10.1097/00007890-200204270-00008.
- Grisham JW. (1962) A morphologic study of deoxyribonucleic acid synthesis and cell proliferation in regenerating rat liver; autoradiography with thymidine-H3. Cancer Res. 22:842-849
- Grisham JW. (1969) Cellular proliferation in the liver. Recent Results. Cancer Res. 17, 28-43
- Grompe M, al-Dhalimy M, Finegold M, Ou CN, Burlingame T, Kennaway NG, Soriano P. (1993) Loss of fumarylacetoacetate hydrolase is responsible for the neonatal hepatic dysfunction phenotype of lethal albino mice. Genes Dev 7(12A):2298-2307. doi: 10.1101/gad.7.12a.2298.
- Grozdanov PN, Yovchev MI, Dabeva MD. (2006) The oncofetal protein glypican-3 is a novel marker of hepatic progenitor/oval cells. Lab Invest 86: 1272-1284. doi: 10.1038/labinvest.3700479
- Hansen B, Longati P, Elvevold K, Nedredal GI, Schledzewski K, Olsen R, Falkowski M, Kzhyshkowska J, Carlsson F, Johansson S, Smedsrød B, Goerdt S, Johansson S, McCourt P. (2005) Stabilin-1 and stabilin-2 are both directed into the early endocytic pathway in hepatic sinusoidal endothelium via interactions with clathrin/AP-2, independent of ligand binding. Exp Cell Res. 303(1):160-173. doi: 10.1016/j.yexcr.2004.09.017
- Heckel JL, Sandgren EP, Degen JL, Palmiter RD, Brinster RL. (1990) Neonatal bleeding in transgenic mice expressing urokinase-type plasminogen activator. Cell. 62(3): 447-56. doi: 10.1016/0092-8674(90)90010-c.
- Hixson DC, Faris RA, Thompson NL. (1990) An antigenic portrait of the liver during carcinogenesis. Pathobiology 58(2):65-77. doi: 10.1159/000163565
- Hoffman PJ. (1964) Changes in the replication times and patterns of the liver cell during the life of the rat. Exp Cell Res 36: 111-123.
- Huch M, Dorrell C, Boj SF, van Es JH, Li VS, van de Wetering M, Sato T, Hamer K, Sasaki N, Finegold MJ, Haft A, Vries RG, Grompe M, Clevers H. (2013) In vitro expansion of single Lgr5+ liver stem cells induced by Wnt-driven regeneration. Nature 494(7436): 247-250. doi: 10.1038/nature11826
- Hulla JE, Juchau MR. (1989) Occurrence and inducibility of cytochrome P450IIIA in maternal and fetal rats during prenatal development. Biochemistry 28: 4871- 4879. doi: 10.1021/bi00437a052.
- Hully JR, Chang L, Schwall RH, Widmer HR, Terrell TG, Gillett NA. (1994) Induction of apoptosis in the murine liver with recombinant human activin A. Hepatology 20(4 Pt 1): 854-862. doi: 10.1002/hep.1840200413.
- Ichikawa T, Zhang YQ, Kogure K, Hasegawa Y, Takagi H, Mori M, Kojima I. (2001) Transforming growth factor beta and activin tonically inhibit DNA synthesis in the rat liver. Hepatology 34(5): 918-925. doi: 10.1053/jhep.2001.29132.
- Ichinohe N, Kon J, Sasaki K, Nakamura Y, Ooe H, Tanimizu N, Mitaka T. (2012) Growth ability and repopulation efficiency of transplanted hepatic stem cells, progenitor cells, and mature hepatocytes in retrorsine-treated rat livers. Cell Transplant 21: 11-22. doi: 10.3727/096368911X580626
- Ichinohe N, Tanimizu N, Ooe H, Nakamura Y, Mizuguchi T, Hirata K, Kon J, Mitaka T. (2013) Differentiation capacity of hepatic stem/progenitor cells isolated from D-galactosamine-treated rat livers. Hepatology, 57(3): 1192-1202 doi: 10.1002/hep.26084
- Ichinohe N, Ishii M, Tanimizu N, Kon J, Yoshioka Y, Ochiya T, Mizuguchi T, Hirata K, Mitaka T. (2017) Transplantation of Thy1+ cells accelerates liver regeneration by enhancing the growth of small hepatocyte-like progenitor cells via IL17RB signaling. Stem Cells 35(4): 920-931. doi: 10.1002/stem.2548
- Ichinohe N, Ishii M, Tanimizu N, Mizuguchi T, Yoshioka Y, Ochiya T, Suzuki H, Mitaka T. (2021) Extracellular vesicles containing miR-146a-5p secreted by bone marrow mesenchymal cells activate hepatocytic progenitors in regenerating rat livers. Stem Cell Res Ther 12(1): 312. doi: 10.1186/s13287-021-02387-6.
- Ichinohe N, Tanimizu N, Ishigami K, Yoshioka Y, Fuitani N, Ochiya T, Takahashi M, Mitaka T. (2023) CINC-2 and miR-199a-5p in EVs secreted by transplanted Thy1+ cells activate hepatocytic progenitor cell growth in rat liver regeneration. Stem Cell Res Ther 14(1): 134. doi: 10.1186/s13287-023-03346-z.
- Ikeda S, Mitaka T, Harada K, Sugimoto S, Mochizuki Y. (2002) Proliferation of rat small hepatocytes after long-term cryopreservation. J Hepatology, 37(1), 7-14 DOI: 10.1016/S0168-8278(02)00069-7
- Ishii M, Kino J, Ichinohe N, Tanimizu N, Ninomiya T, Suzuki H, Mizuguchi T, Hirata K, Mitaka T. (2017) Hepatocytic parental progenitor cells of rat small hepatocytes maintain a self-renewal capability after long-term culture. Scientific Reports, 7: 46177 doi: 10.1038/srep46177
- Jensen CH, Jauho EI, Santoni-Rugiu E, Holmskov U, Teisner B, Tygstrup N, Bisgaard HC. (2004) Transit-amplifying ductular (oval) cells and their hepatocytic progeny are characterized by a novel and distinctive expression of delta-like protein/preadipocyte factor 1/fetal antigen 1. Am J Pathol 164; 1347-1359. doi: 10.1016/S0002-9440(10)63221-X
- Katoonizadeh A, Nevens F, Verslype C, Pirenne, J, Roskams T. (2006) Liver regeneration in acute severe liver impairment: A clinicopathological correlation study. Liver Int 26: 1225-1233. doi: 10.1111/j.1478-3231.2006.01377.x
- Kelsey G, Ruppert S, Beermann F, Grund C, Tanguay RM, Schütz G. (1993) Rescue of mice homozygous for lethal albino deletions: implications for an animal model for the human liver disease tyrosinemia type 1. Genes Dev 7(12A):2285-97. doi: 10.1101/gad.7.12a.2285.
- Kennedy S, Rettinger S, Flye W, Ponder KP. (1995) Experiments in transgenic mice show that hepatocytes are the source for postnatal liver growth and do not stream. Hepatology 22, 160-168.
- Khokha MK, Landini G, Iannaccone PM. (1994) Fractal geometry in rat chimeras demonstrates that a repetitive cell division program may generate liver parenchyma. Dev Biol. 165, 545-555. doi: 10.1006/dbio.1994.1274.
- Kikkawa Y, Mochizuki Y, Miner JH, Mitaka T. (2005) Transient expression of LN 1 chain in regenerating murine liver: restricted localization of laminin chains and nidogen-1. Exp Cell Res 305: 99-109. doi: 10.1016/j.yexcr.2005.01.005.
- Kino J, Ichinohe N, Ishii M, Suzuki H, Mizuguchi T, Tanimizu N, Mitaka T. (2019) Self‐Renewal Capability of Hepatocytic Parental Progenitor Cells Derived From Adult Rat Liver Is Maintained Long Term When Cultured on Laminin 111 in Serum‐Free Medium. Hepatol Commun 4(1): 21-37. doi: 10.1002/hep4.1442
- Kleinman HK, McGarvey ML, Liotta LA, Robey PG, Tryggvason K, Martin GR. (1982) Isolation and characterization of type IV procollagen, laminin, and heparan sulfate proteoglycan from the EHS sarcoma. Biochemistry 21: 6188-6193. doi: 10.1021/bi00267a025.
- Knight B, Matthews VB, Olynyk JK, Yeoh GC. (2005) Jekyll and Hyde: evolving perspectives on the function and potential of the adult liver progenitor (oval) cell. Bioessays 27:1192-1202. doi: 10.1002/bies.20311.
- Ko S, Russell JO, Molina LM, Monga SP. (2020) Liver progenitors and adult cell plasticity in hepatic injury and repair: Knowns and Unknowns. Annu Rev Pathol 15:23-50. doi: 10.1146/annurev-pathmechdis-012419-032824.
- Kogure K, Omata W, Kanzaki M, Zhang YQ, Yasuda H, Mine T, Kojima I. (1995) A single intraportal administration of follistatin accelerates liver regeneration in partially hepatectomized rats. Gastroenterology. 108(4): 1136-1142. doi: 10.1016/0016-5085(95)90212-0
- Kogure K, Zhang YQ, Maeshima A, Suzuki K, Kuwano H, Kojima I. (2000) The role of activin and transforming growth factor-beta in the regulation of organ mass in the rat liver. Hepatology 31(4): 916-921. doi: 10.1053/he.2000.6100
- Kon J, Ooe H, Oshima H Kikkawa Y, Mitaka T. (2006) Expression of CD44 in rat hepatic progenitor cells. J Hepatol 45: 90-98. doi: 10.1016/j.jhep.2006.01.029
- Kon J, Ichinohe N, Ooe H, Chen Q, Sasaki K, Mitaka T. (2009) Thy1-positive cells have bipotential ability to differentiate into hepatocytes and biliary epithelial cells in galactosamine-induced rat liver regeneration. Am J Pathol 175: 2362-2371. doi: 10.2353/ajpath.2009.080338
- Kubo Y, Yasunaga M, Masuhara M, Terai S, Nakamura T, Okita K. (1996) Hepatocyte proliferation induced in rats by lead nitrate is suppressed by several tumor necrosis factor alpha inhibitors. Hepatology 23(1): 104-114. doi: 10.1053/jhep.1996.v23.pm0008550029
- Kubota H, Reid LM. (2000) Clonogenic hepatoblasts, common precursors for hepatocytic and biliary lineages, are lacking classical major histocompatibility complex class I antigen. Proc Natl Acad Sci USA 97, 12132-12137. doi: 10.1073/pnas.97.22.12132.
- Laconi E, Sarma DS, Pani P. (1995) Transplantation of normal hepatocytes modulates the development of chronic liver lesions induced by a pyrrolizidine alkaloid, lasiocarpine. Carcinogenesis 16: 139-142. doi: 10.1093/carcin/16.1.139.
- Laconi E, Oren R, Mukhopadhyay DK, Hurston E, Laconi S, Pani P, Dabeva MD, Shafritz DA. (1998) Long-term, near-total liver replacement by transplantation of isolated hepatocytes in rats treated with retrorsine. Am J Pathol 153: 319-329. doi: 10.1016/S0002-9440(10)65574-5.
- Lázaro CA, Croager EJ, Mitchell C, Campbell JS, Yu C, Foraker J, Rhim JA, Yeoh GC, Fausto N.(2003) Establishment, characterization, and long-term maintenance of cultures of human fetal hepatocytes. Hepatology 38: 1095-1106. https://doi.org/10.1053/jhep.2003.50448
- Leblond CP. (1964) Classification of cell populations on the basis of their proliferative hebavior. Natl Cancer Inst Monogr. 14:119-150
- LeBouton AV, Marchand R. (1970) Changes in the distribution of thymidine-3H labeled cells in the growing liver acinous of neonatal rats. Dev Biol 23: 524-552. doi: 10.1016/0012-1606(70)90138-7.
- Ledda-Columbano GM, Columbano A, Cannas A, Simbula G, Okita K, Kayano K, Kubo Y, Katyal SL, Shinozuka H. (1994) Dexamethasone inhibits induction of liver tumor necrosis factor-alpha mRNA and liver growth induced by lead nitrate and ethylene dibromide. Am J Pathol 145(4): 951-958.
- Lefkowitch JH. (2016) The Pathology of Acute Liver Failure. Adv Anat Pathol 23(3): 144-158. doi: 10.1097/PAP.0000000000000112
- Lemire JM, Shiojiri N, Fausto N. (1991) Oval cell proliferation and the origin of small hepatocytes in liver injury induced by D-galactosamine. Am J Pathol 139(3): 535-552
- Lesch R, Reutter W, Keppler D, Decker K. (1970) Liver restitution after acute galactosamine hepatitis: Autoradiographic and biochemical studies in rats. Exp Mol Pathol 12: 58-69. https://doi.org/10.1016/0014-4800(70)90075-4
- Libbrecht L, Desmet V, Van Damme B, Roskams T. (2000) Deep intralobular extension of human hepatic 'progenitor cells' correlates with parenchymal inflammation in chronic viral hepatitis: can 'progenitor cells' migrate? J Pathol 192(3): 373-378. doi: 10.1002/1096-9896(2000)9999:9999<::AID-PATH700>3.0.CO;2-5.
- Lin S, Nascimento EM, Gajera CR, Chen L, Neuhöfer P, Garbuzov A, Wang S, Artandi SE. (2018) Distributed hepatocytes expressing telomerase repopulate the liver in homeostasis and injury. Nature. 556(7700): 244-248. doi: 10.1038/s41586-018-0004-7.
- Lowes KN, Brennan BA, Yeoh GC, Olynyk JK. (1999) Oval cell numbers in human chronic liver diseases are directly related to disease severity. Am J Pathol 154(2): 537-541. doi: 10.1016/S0002-9440(10)65299-6.
- MacDonald RA. (1961) Lifespan of liver cells. Arch Int Med 107:79-87
- Magami Y, Azuma T, Inokuchi H, Kokuno S, Moriyasu F, Kawai K, Hattori T. (2002) Cell proliferation and renewal of normal hepatocytes and bile duct cells in adult mouse liver. Liver 22(5):419-425. doi: 10.1034/j.1600-0676.2002.01702.x.
- Marshall A, Rushbrook S, Davies SE, Morris LS, Scott IS, Vowler SL, Coleman N, Alexander G. (2005) Relation between hepatocyte G1 arrest, impaired hepatic regeneration, and fibrosis in chronic hepatitis C virus infection. Gastroenterology 128: 33-42. https://doi.org/10.1053/j.gastro.2004.09.076
- Masson NM, Currie IS, Terrace JD, Garden OJ, Parks RW, Ross JA. (2006) Hepatic progenitor cells in human fetal liver express the oval cell marker Thy-1. Am J Physiol Gastrointest Liver Physiol. 291(1): G45-54. doi: 10.1152/ajpgi.00465.2005
- McLean EK. (1970) The toxic actions of pyrrolizidine (senecio) alkaloids. Pharmacol Rev 42: 429-483.
- Medline A, Schaffner F, Popper H. (1970) Ultrastructural features in galactosamine-induced hepatitis. Exp Mol Pathol 12: 201-211. doi: 10.1016/0014-4800(70)90050-x.
- Menthena A, Koehler CI, Sandhu JS, Yovchev MI, Hurston E, Shafritz DA, Oertel M. (2011) Activin A, p15INK4b signaling, and cell competition promote stem/progenitor cell repopulation of livers in aging rats. Gastroenterology. 140(3):1009-1020. doi: 10.1053/j.gastro.2010.12.003.
- Michalopoulos GK. (1990) Liver regeneration: molecular mechanisms of growth control. FASEB J 4(2):176-187.
- Michalopoulos GK. (2007) Liver regeneration. J Cell Physiol. 213(2): 286-300. doi: 10.1002/jcp.21172
- Michalopoulos GK, Khan Z. (2015) Liver Stem Cells: Experimental Findings and Implications for Human Liver Disease. Gastroenterology. 2015 Oct;149(4):876-882. doi: 10.1053/j.gastro.2015.08.004.
- Mitaka T, Tsukada H. (1987) Sexual difference in the histochemical characteristics of "altered cell foci" in the liver of aged Fischer 344 rats. Jpn J Cancer Res. 78(8): 785-790.
- Mitaka T, Mikami M, Sattler GL, Pitot HC, Mochizuki Y. (1992) Small cell colonies appear in the primary culture of adult rat hepatocytes in the presence of nicotinamide and epidermal growth factor. Hepatology; 16: 440-447. doi: 10.1002/hep.1840160224.
- Mitaka T, Norioka K, Sattler GL, Pitot HC, Mochizuki Y. (1993a) Effect of age on the formation of small-cell colonies in cultures of primary rat hepatocytes. Cancer Res 53: 3145-3148.
- Mitaka T, Norioka K, Nakamura T, Mochizuki, Y. (1993b) Effects of mitogens and co-mitogens on the formation of small-cell colonies in primary cultures of rat hepatocytes. J Cell Physiol 157: 461-468. doi: 10.1002/jcp.1041570305.
- Mitaka T, Kojima T, Mizuguchi T, Mochizuki Y. (1995a) Growth and maturation of small hepatocytes isolated from adult rat liver. Biochem Biophys Res Commun 214: 310-317. doi: 10.1006/bbrc.1995.2289.
- Mitaka T, Kojima T, Norioka K, Mochizuki Y. (1995b) TGF- completely blocks the formation of small-cell colonies: Effects of mito-inhibitory factors on the proliferation of primary cultured rat hepatocytes. Cell Struct. Funct., 20(2), 167-176.
- Mitaka T. (1998) The current status of primary hepatocyte culture. Internat J Exp Pathol 79: 393-409. doi: 10.1046/j.1365-2613.1998.00083.x.
- Mitaka T, Sato F, Mizuguchi T, Yokono T, Mochizuki Y. (1999) Reconstruction of hepatic organoid by rat small hepatocytes and hepatic nonparenchymal cells. Hepatology 29: 111-125. doi: 10.1002/hep.510290103.
- Mitaka T. (2002) Reconstruction of hepatic organoid by hepatic stem cells. J Hepatobiliary Pancreat Surg. 9(6):697-703. doi: 10.1007/s005340200096.
- Mitaka T, Ichinohe N, Tanimizu N. (2023) "Small hepatocytes" in the liver. Cells 12(23): 2718. doi: 10.3390/cells12232718.
- Miyajima A, Tanaka M, Itoh T. (2014) Stem/progenitor cells in liver development, homeostasis, regeneration, and reprogramming. Cell Stem Cell 14: 561-574. doi: 10.1016/j.stem.2014.04.010.
- Miyaoka Y, Ebato K, Kato H, Arakawa S, Shimizu S, Miyajima A. (2012) Hypertrophy and unconventional cell division of hepatocytes underlie liver regeneration. Curr Biol. 22(13): 1166-1175. doi: 10.1016/j.cub.2012.05.016.
- Mouta Carreira C, Nasser SM, di Tomaso E, Padera TP, Boucher Y, Tomarev SI, Jain RK. (2001) LYVE-1 is not restricted to the lymph vessels: expression in normal liver blood sinusoids and down-regulation in human liver cancer and cirrhosis. Cancer Res. 61(22): 8079-84.
- Nagy P, Kiss A, Schnur J, Thorgeirsson SS. (1998) Dexamethasone inhibits the proliferation of hepatocytes and oval cells but not bile duct cells in rat liver. Hepatology 28(2): 423-429. doi: 10.1002/hep.510280220
- Ng Y-K, Iannaccone PM. (1992) Fractal geometry of mosaic pattern demonstrates liver regeneration is a self-similar process. Dev. Biol. 151, 419-430. doi: 10.1016/0012-1606(92)90182-g.
- Nishiuchi R, Takagi J, Hayashi M, Ido H, Yagi Y, Sanzen N, Tsuji T, Yamada M, Sekiguchi K. (2006) Ligand-binding specificities of laminin-binding integrins: a comprehensive survey of laminin-integrin interactions using recombinant and integrins. Matrix Biol 25: 189-197. doi: 10.1016/j.matbio.2005.12.001
- Oertel M, Menthena A, Chen YQ, Shafritz DA. (2007) Comparison of hepatic properties and transplantation of Thy-1(+) and Thy-1(-) cells isolated from embryonic day 14 rat fetal liver. Hepatology 46(4): 1236-1245. doi: 10.1002/hep.21775
- Omiecinski CJ, Hassett C, Costa P. (1990) Developmental expression and in situ localization of the phenobarbital-inducible rat hepatic mRNAs for cytochromes CYP2B1, CYP2B2, CYP2C6, and CYP 3A1. Mol Pharmacol 38: 462-470
- Ooe H, Kon J, Miyamoto S, Oozone Y, Ninomiya S, Mitaka T. (2006) Cytochrome P450 expressions of cultured rat small hepatocytes after long-term cryopreservation. Drug Metab Disposit, 34(10): 1667-1671 DOI: 10.1124/dmd.105.008342
- Ooe H, Kon J, Oshima H, Mitaka T. (2009) Thyroid hormone is necessary for expression of constitutive androstane receptor in rat hepatocytes. Drug Metabol Dispos, 37(9), 1963-1969 doi: 10.1124/dmd.108.022905
- Ooe H, Chen Q, Kon J, Sasaki K, Miyoshi H, Ichinohe N, Tanimizu N, Mitaka T. (2012) Proliferation of rat small hepatocytes requires follistatin expression. J Cell Physiol 227(6): 2363-2370. doi: 10.1002/jcp.22971
- Oren R, Dabeva MD, Karnezis, AN, Petkov PM, Rosencrantz R, Sandhu JP, Moss SF, Wang S, Hurston E, Laconi E, Holt PR, Thung SN, Zhu L, Shafritz DA. (1999). Role of thyroid hormone in stimulating liver repopulation in the rat by transplanted hepatocytes. Hepatology 30: 903-913. doi: 10.1002/hep.510300418.
- Overturf K, Al-Dhalimy M, Tanguay R, Brandtly M, Ou CN, Finegold M, Grompe M. (1996) Hepatocytes corrected by gene therapy are selected in vivo in a murine model of hereditary tyrosinaemia type I. Nat Genet, 12: 266-273. doi: 10.1038/ng0396-266.
- Overturf K, Al-Dhalimy M, Ou C-N, Finegold M, Grompe M. (1997) Serial transplantation reveals the stem-cell-like regenerative potential of adult mouse hepatocytes. Am J Pathol 151: 1273-1280.
- Paku S, Nagy P, Kopper L, Thorgeirsson SS. (2004) 2-Acetylaminofluorene dose-dependent differentiation of rat oval cells into hepatocytes: confocal and electron microscopic studies. Hepatology. 39(5): 1353-1361. doi: 10.1002/hep.20178.
- Petersen BE, Goff JP, Greenberger JS, Michalopoulos GK. (1998) Hepatic oval cells express the hematopoietic stem cell marker Thy-1 in the rat. Hepatology 27: 433-445. doi: 10.1002/hep.510270218.
- Petersen BE, Bowen WC, Patrene KD, Mars WM, Sullivan AK, Murase N, Boggs SS, Greenberger JS, Goff JP. (1999) Bone marrow as a potential source of hepatic oval cells. Science. 284(5417):1168-70. doi: 10.1126/science.284.5417.1168.
- Planas-Paz L, Orsini V, Boulter L, Calabrese D, Pikiolek M, Nigsch F, Xie Y, Roma G, Donovan A, Marti P, Beckmann N, Dill MT, Carbone W, Bergling S, Isken A, Mueller M, Kinzel B, Yang Y, Mao X, Nicholson TB, Zamponi R, Capodieci P, Valdez R, Rivera D, Loew A, Ukomadu C, Terracciano LM, Bouwmeester T, Cong F, Heim MH, Forbes SJ, Ruffner H, Tchorz JS. (2016) The RSPO-LGR4/5-ZNRF3/RNF43 module controls liver zonation and size. Nat Cell Biol 18(5):467-479. doi: 10.1038/ncb3337.
- Popper H. (1986) Aging and the liver. In: H. Popper and F. Schaffner (eds.), Progress in Liver Diseases, Vol. 8. pp. 659-683. Philadelphia: W. B. Saunders Company.
- Pu W, Zhang H, Huang X, Tian X, He L, Wang Y, Zhang L, Liu Q, Li Y, Li Y, Zhao H, Liu K, Lu J, Zhou Y, Huang P, Nie Y, Yan Y, Hui L, Lui KO, Zhou B. (2016) Mfsd2a+ hepatocytes repopulate the liver during injury and regeneration. Nat Commun. 7: 13369. doi: 10.1038/ncomms13369
- Quaglia A, Portmann BC, Knisely AS, Srinivasan P, Muiesan P, Wendon J, Heneghan MA, O'Grady JG, Samyn M, Hadzic D, Dhawan A, Mieli-Vergani G, Heaton N, Rela M. (2008) Auxiliary transplantation for acute liver failure: Histopathological study of native liver regeneration. Liver Transpl 14(10): 1437-1448. doi: 10.1002/lt.21568.
- Rhim JA, Sandgren EP, Degen JL, Palmiter RD, Brinster RL. (1994) Replacement of diseased mouse liver by hepatic cell transplantation. Science 263: 1149-1152. doi: 10.1126/science.8108734.
- Rich KJ, Boobis AR. (1997) Expression and inducibility of P450 enzymes during liver ontogeny. Microsc Res Tech 39: 424 - 435. doi: 10.1002/(SICI)1097-0029(19971201)39:5<424::AID-JEMT5>3.0.CO;2-G.
- Rodgarkia-Dara C, Vejda S, Erlach N, Losert A, Bursch W, Berger W, Schulte-Hermann R, Grusch M. (2006) The activin axis in liver biology and disease. Mutat Res 613(2-3): 123-137. doi: 10.1016/j.mrrev.2006.07.002.
- Rodin S, Domogatskaya A, Ström S, Hansson EM, Chien KR, Inzunza J, Hovatta O, Tryggvason K. (2010) Long-term self-renewal of human pluripotent stem cells on human recombinant LN511. Nat Biotechnol 28: 611-615. doi: 10.1038/nbt.1620.
- Roskams T, Desmet V. (1998a) Ductular reaction and its diagnostic significance. Semin Diagn Pathol 15: 259-269.
- Roskams T, De Vos R, Van Eyken P, Myazaki ,H, Van Damme B, Desmet V. (1998b) Hepatic OV-6 expression in human liver disease and rat experiments: Evidence for hepatic progenitor cells in man. J Hepatol 29: 455-463. https://doi.org/10.1016/s0168-8278(98)80065-2
- Roskams T, Yang SQ, Koteish A, Durnez A, DeVos R, Huang X, Achten R, Verslype C, Diehl AM. (2003) Oxidative stress and oval cell accumulation in mice and humans with alcoholic and nonalcoholic fatty liver disease. Am J Pathol 163: 1301-1311. https://doi.org/10.1016/S0002-9440(10)63489-X
- Roskams TA, Theise ND, Balabaud C, Bhagat G, Bhathal PS, Bioulac-Sage P, Brunt EM, Crawford JM, Crosby HA, Desmet V, Finegold MJ, Geller SA, Gouw AS, Hytiroglou P, Knisely AS, Kojiro M, Lefkowitch JH, Nakanuma Y, Olynyk JK, Park YN, Portmann B, Saxena R, Scheuer PJ, Strain AJ, Thung SN, Wanless IR, West AB. (2004) Nomenclature of the finer branches of the biliary tree: canals, ductules, and ductular reactions in human livers. Hepatology. 39(6):1739-45. doi: 10.1002/hep.20130.
- Roskams TA. (2006) Different types of liver progenitor cells and their niches. J Hepatol 45:1-4. doi: 10.1016/j.jhep.2006.05.002.
- Sandgren EP, Palmiter RD, Heckel JL, Daugherty CC, Brinster RL, Degen JL. (1991) Complete hepatic regeneration after somatic deletion of an albumin-plasminogen activator transgene. Cell 66: 245-256. doi: 10.1016/0092-8674(91)90615-6.
- Sarraf C, Lalani EN, Golding M, Anilkumar TV, Poulsom R, Alison M. (1994) Cell behavior in the acetylaminofluorene-treated regenerating rat liver. Light and electron microscopic observations. Am J Pathol. 145(5):1114-1126.
- Sato H, Funahashi M, Kristensen DB, Tateno C, Yoshizato K. (1999) Pleiotrophin as a Swiss 3T3 cell-derived potent mitogen for adult rat hepatocytes. Exp Cell Res 246: 152-164. https://doi.org/10.1006/excr.1998.4304.
- Sawada N, Ishikawa T. (1988) Reduction of potential for replicative but not unscheduled DNA synthesis in hepatocytes isolated from aged as compared to young rats. Cancer Res 48: 1618-1622.
- Schapiro H, Hotta S, Outten WE, Klein AW. (1982) The effect of aging on rat liver regeneration. Experientia (Basel). 38: 1075-1076. doi: 10.1007/BF01955375.
- Schneyer A, Schoen A, Quigg A, Sidis Y. (2003) Differential binding and neutralization of activins A and B by follistatin and follistatin like-3 (FSTL-3/FSRP/FLRG). Endocrinology 144(5): 1671-1674. doi: 10.1210/en.2002-0203.
- Schwall RH, Robbins K, Jardieu P, Chang L, Lai C, Terrell TG. (1993) Activin induces cell death in hepatocytes in vivo and in vitro. Hepatology. 18(2): 347-356. doi: 10.1016/0270-9139(93)90018-i.
- Sell S. (1994) Liver stem cells. Mod Pathol, 7(1): 105-112.
- Sell S. (2001) Heterogeneity and plasticity of hepatocyte lineage cells. Hepatology 2001; 33: 738-750. doi: 10.1053/jhep.2001.21900.
- Shiojiri N, Imai H, Goto S, Ohta T, Ogawa K, Mori M. (1997) Mosaic pattern of ornithine transcarbamylase expression in spfash mouse liver. Am J Pathol, 151(2): 413-421.
- Sigal SH, Gupta S, Gebhard jr DF, Holst P, Neufeld D, Reid LM. (1995) Evidence for a terminal differentiation process in the liver. Differentiation 59: 35-42
- Sirica AE (1995). Ductular hepatocytes. Histol Histopathol 10: 433-456.
- Stanger BZ. (2015) Cellular homeostasis and repair in the mammalian liver. Annu Rev Physiol 77: 179-200. doi: 10.1146/annurev-physiol-021113-170255.
- Steiner JW, Perz ZM, Taichman LB. (1966) Cell population dynamics in the liver. A review of quantitative morphological techniques applied to the study of physiological and pathological growth. Exp Mol Pathol 5:146-181. doi: 10.1016/0014-4800(66)90012-8.
- Stöcker E, Heine WD. (1971) Regeneration of liver parenchyma under normal and pathological conditions. Beitr Pathol. 144(4): 400-408
- Sugimoto S, Mitaka T, Ikeda S, Harada K, Ikai I, Yamaoka Y, Mochizuki Y. (2002) Morphological changes induced by extracellular matrix are correlated with maturation of rat small hepatocytes. J Cell Biochem 87(1): 16-28. doi: 10.1002/jcb.10274.
- Suzuki A, Zheng Y, Kaneko S, Onodera M, Fukao K, Nakauchi H, Taniguchi, H. (2002). Clonal identification and characterization of self-renewing pluripotent stem cells in the developing liver. J. Cell Biol. 156: 173-184. doi: 10.1083/jcb.200108066.
- Takabe K, Wang L, Leal AM, Macconell LA, Wiater E, Tomiya T, Ohno A, Verma IM, Vale W. (2003) Adenovirus-mediated overexpression of follistatin enlarges intact liver of adult rats. Hepatology 38(5): 1107-1115. doi: 10.1053/jhep.2003.50483
- Takayama K, Nagamoto Y, Mimura N, Tashiro K, Sakurai F, Tachibana M, Hayakawa T, Kawabata K, Mizuguchi H. (2013) Long-term self-renewal of human ES/iPS-derived hepatoblast-like cells on human LN111-coated dishes. Stem Cell Rep 1(4): 322-335. doi: 10.1016/j.stemcr.2013.08.006.
- Tanimizu N, Nishikawa M, Saito H, Tsujimura T. Miyajima A. (2003). Isolation of hepatoblasts based on the expression of Dlk/Pref-1. J Cell Sci 116: 1775-1786. doi: 10.1242/jcs.00388.
- Tanimizu N, Saito H, Mostov K, Miyajima A. (2004) Long-term culture of hepatic progenitors derived from mouse Dlk+ hepatoblasts. J Cell Sci 117: 6425-6434. doi: 10.1242/jcs.01572.
- Tanimizu N, Kikkawa Y, Mitaka T, Miyajima A. (2012) α1- and α5-containing laminins regulate the development of bile ducts via β1 integrin signals. J Biol Chem 287: 28586-28597. doi: 10.1074/jbc.M112.350488
- Tanimizu N, Ichinohe N, Ishii M, Kino J, Mizuguchi T, Hirata K, Mitaka T. (2016) Liver progenitors isolated from adult healthy mouse liver efficiently differentiate to functional hepatocytes in vitro and repopulate liver tissue. Stem Cells 34(12): 2889-2901. doi: 10.1002/stem.2457.
- Tateno C, Yoshizato K. (1996) Long-Term Cultivation of Adult Rat Hepatocytes That Undergo Multiple Cell Divisions and Express Normal Parenchymal Phenotypes. Am J Pathol, 148: 383-392.
- Tateno C, Takai-Kajihara K, Yamasaki C, Sato H, Yoshizato K. (2000) Heterogeneity of growth potential of adult rat hepatocytes. Hepatology 31: 65-74. doi: 10.1002/hep.510310113.
- Theise ND, Saxena R, Portmann BC, Thung SN, Yee H, Chiriboga L, Kumar A, Crawford JM. (1999) The canals of Hering and hepatic stem cells in humans. Hepatology. 30(6): 1425-1433. doi: 10.1002/hep.510300614.
- Thorgeirsson SS, Grisham JW. (2003) Overview of recent experimental studies on liver stem cells. Semin Liver Dis 23: 303-312. doi: 10.1055/s-2004-815559.
- Umar S. (2010) Intestinal stem cells. Curr Gastroenterol Rep 12(5):340-348. doi: 10.1007/s11894-010-0130-3.
- Van Eyken P, Sciot R, Callea F, Van der Steen K, Moerman P, Desmet V. (1988) The development of the intrahepatic bile ducts in man: A keratin-immunohistochemical study. Hepatology 8: 1586-1595. https://doi.org/10.1002/hep.1840080619
- Van Eyken, P, Desmet VJ. (1993) Cytokeratins and the liver. Liver 13: 113-122. https://doi.org/10.1111/j.1600-0676.1993.tb00617.x
- Wang B, Zhao L, Fish M, Logan CY, Nusse R. (2015) Self-renewing diploid Axin2(+) cells fuel homeostatic renewal of the liver. Nature 524(7564): 180-185. doi: 10.1038/nature14863
- Weinstein GD, McCullough JL, Ross P. (1984) Cell proliferation in normal epidermis. J Invest Dermatol 82(6):623-628. doi: 10.1111/1523-1747.ep12261462.
- Weng HL, Cai X, Yuan X, Liebe R, Dooley S, Li H, Wang TL. (2015) Two sides of one coin: massive hepatic necrosis and progenitor cell-mediated regeneration in acute liver failure. Front Physiol 6: 178. doi: 10.3389/fphys.2015.00178
- Wiemann SU, Satyanarayana A, Tsahuridu M, Tillmann HL, Zender L, Klempnauer J, Flemming P, Franco S, Blasco MA, Manns MP, Rudolph KL. (2002) Hepatocyte telomere shortening and senescence are general markers of human liver cirrhosis. FASEB J 16: 935-942. doi: 10.1096/fj.01-0977com
- Wright N, Alison M. (1984) The liver. In The Biology of Epithelial Cell Populations. Vol. 2. Clarendon Press, Oxford: pp.890-908
- Yamada M, Sekiguchi K. (2015) Molecular basis of laminin-integrin interactions. Curr Top Membr 76: 197-229. doi: 10.1016/bs.ctm.2015.07.002.
- Yasuda H, Mine T, Shibata H, Eto Y, Hasegawa Y, Takeuchi T, Asano S, Kojima I. (1993) Activin A: an autocrine inhibitor of initiation of DNA synthesis in rat hepatocytes. J Clin Invest 92(3): 1491-1496. doi: 10.1172/JCI116727.
- Zajicek G, Oren R, Weinreb M. (1985) The streaming liver. Liver 5, 293-300. doi: 10.1111/j.1600-0676.1985.tb00252.x.
- Zhao L, Jin Y, Donahue K, Tsui M, Fish M, Logan CY, Wang B, Nusse R. (2019) Tissue Repair in the Mouse Liver Following Acute Carbon Tetrachloride Depends on Injury-Induced Wnt/β-Catenin Signaling. Hepatology 69(6): 2623-2635. doi: 10.1002/hep.30563
- Zöller M. (2011) CD44: can a cancer-initiating cell profit from an abundantly expressed molecule? Nat Rev Cancer 11(4): 254-267. doi: 10.1038/nrc3023.