研究交流
ヒトiPS細胞由来肝オルガノイドの樹立とその二次元培養による肝細胞の成熟化
乾純平1、植山(鳥羽)由希子1, 2, 3、水口裕之1, 2, 3, 4
1. 大阪大学大学院薬学研究科、2. 医薬基盤・健康・栄養研究所、
3. 大阪大学先導的学際研究機構、4. 大阪大学国際医工情報センター
はじめに
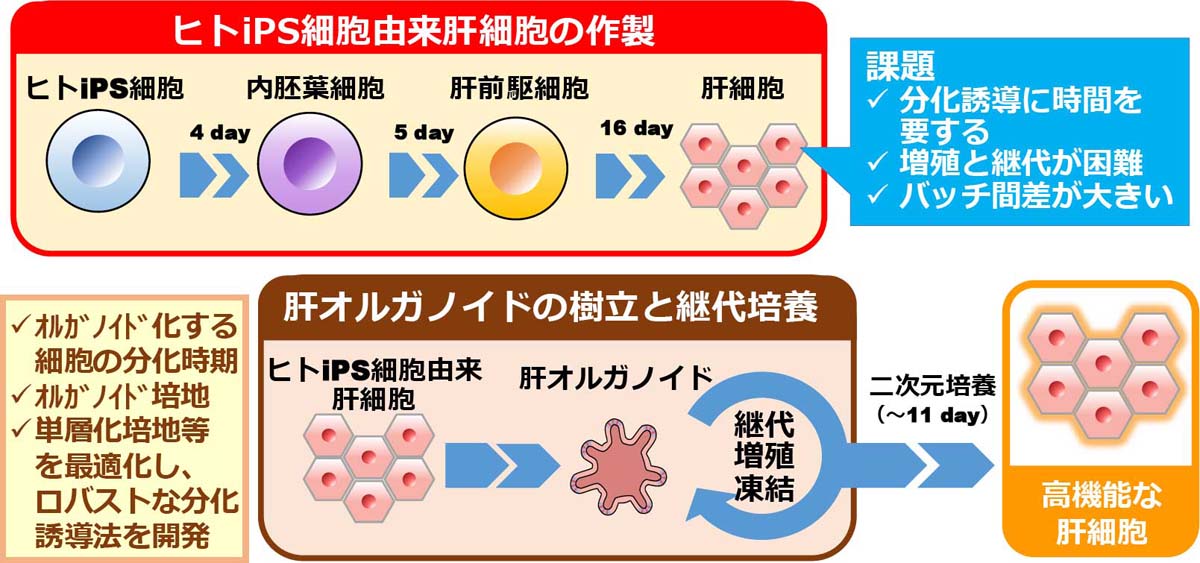
ヒトinduced pluripotent stem (iPS)細胞から分化誘導して得られる肝細胞(ヒトiPS細胞由来肝細胞)は再生医療や創薬研究への応用が期待されている[1, 2] 。しかし、ヒトiPS細胞由来肝細胞は薬物代謝酵素活性などの肝機能が低いことや[3-5]、ヒトiPS細胞から肝細胞への分化誘導に3-4週間の期間を要すること、最終分化後のヒトiPS細胞由来肝細胞は増殖しないため、大量に細胞製造するにはコストと労力を要することなどが課題となっている。そこで我々は、近年注目されているオルガノイド培養技術によって、これらの課題の解決を試みた。さらに、創薬研究への汎用性を向上させるために、ヒトiPS細胞由来肝オルガノイドを二次元培養し、肝細胞への成熟化を促す分化培地で培養することで、ヒト初代培養肝細胞に匹敵する肝機能を示す肝細胞の作出に成功した[6](図1)。本稿では、ヒトiPS細胞由来肝オルガノイドの特性と、創薬応用に向けた肝細胞の高機能化に関する我々の取り組みを紹介する。
ヒトiPS細胞由来肝細胞から肝オルガノイドの樹立
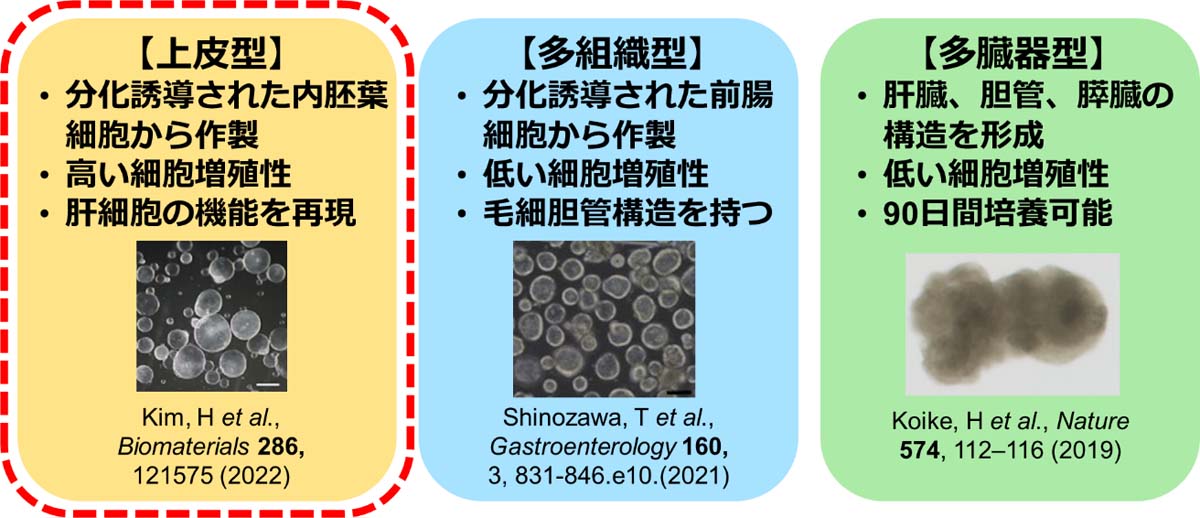
オルガノイドとは自己組織化し臓器に近い特徴を有する三次元構造体であり、これまでに様々な組織細胞や多能性幹細胞から樹立されている。ヒトiPS細胞を用いた肝オルガノイド技術も多く開発されており、それぞれの特徴から大きく上皮型、多組織型、多臓器型の三種類に分類される[7](図2)。我々はその中でも、肝細胞の創薬応用を目的に研究を展開している背景から、細胞増殖と機能維持の両立が可能といわれている上皮型肝オルガノイドに注目した。
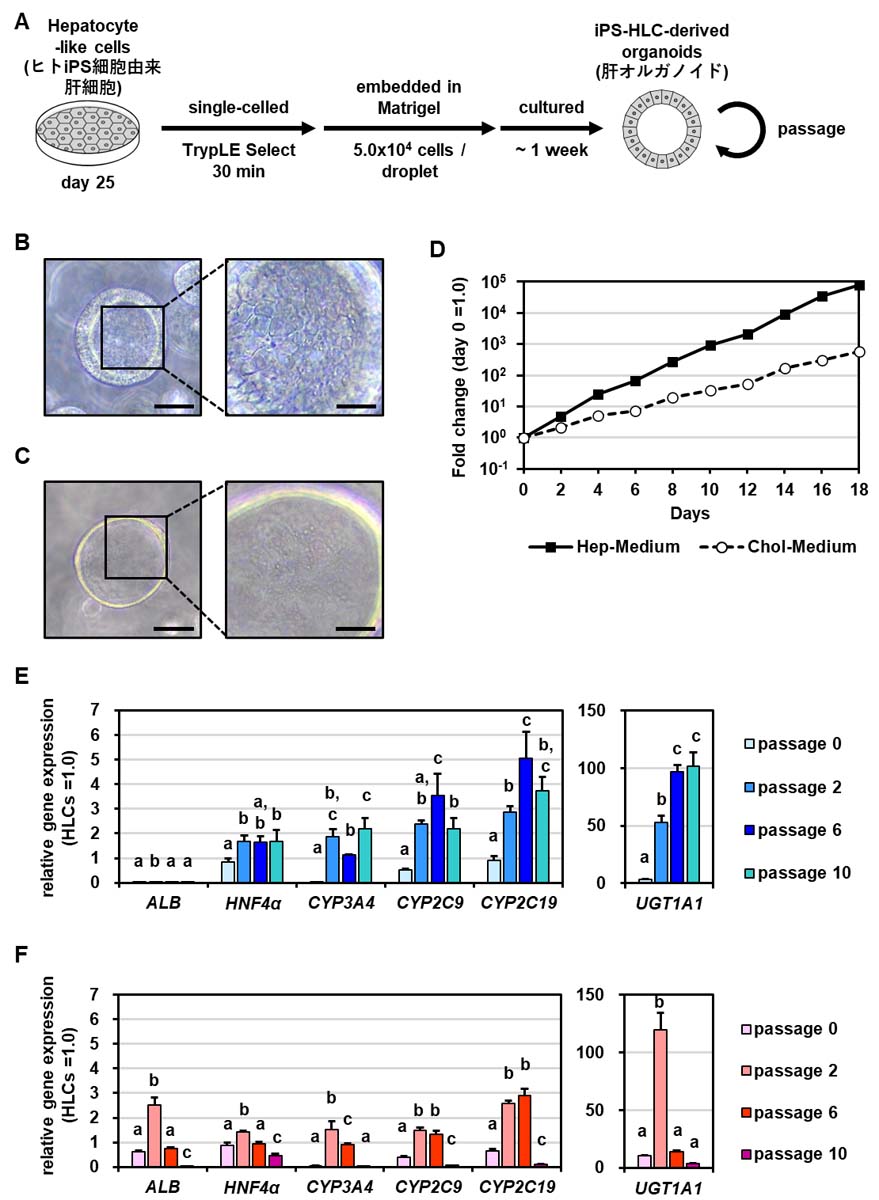
まず、肝オルガノイドの樹立、および培養に最適な培地について検討した。分化誘導によって得られたヒトiPS細胞由来肝細胞をシングルセルに解離し、マトリゲルに懸濁してドロップレットを作製した。このドロップレットを、ヒトおよびマウス肝細胞由来オルガノイドの樹立・培養の際に使用されていた2種類の培地であるHep-Medium(Hep培地)、およびChol-Medium(Chol培地)[8, 9]で培養することで、肝オルガノイドの樹立を試みた(図3A)。その結果、Hep培地で樹立・培養した肝オルガノイド(Hep培地群)は厚い細胞層を有し、肝細胞様の多角形の細胞で構成されていた(図3B)。対照的に、Chol培地で樹立・培養した肝オルガノイド(Chol培地群)の細胞層は薄く、細胞形態は不明瞭であった(図3C)。Hep培地群は18日間で約105倍まで増殖し、これはChol培地群の約100倍であった(図3D)。Hep培地群は、ALBを除くほとんどの肝細胞マーカー遺伝子が高発現しており、少なくとも10継代目までこの傾向を維持していた(図3E)。一方、Chol培地群はこれらの遺伝子発現の増加が弱く、10継代目における遺伝子発現量はヒトiPS細胞由来肝細胞よりも減少していた(図3F)。したがって、Chol培地よりもHep培地の方が肝オルガノイドの樹立および培養に適していることが明らかとなった。
また、ヒトiPS細胞由来肝細胞から肝オルガノイドを樹立するにあたり、オルガノイド培養に最適なヒトiPS細胞由来肝細胞の分化段階についても検討した。既報ではヒトiPS細胞から分化させた内胚葉をオルガノイド培養に用いているが[10, 11]、マウスやヒトの成熟肝細胞からもオルガノイドが樹立できることから[9]、我々は最終分化させたヒトiPS細胞由来肝細胞を含む、各分化段階の細胞からオルガノイドの樹立を試みた。Hep培地を用いてヒトiPS細胞由来の内胚葉、肝前駆細胞、肝細胞からオルガノイドを樹立しその特性を解析したところ、ヒトiPS細胞由来肝細胞から樹立した肝オルガノイドが最も肝細胞マーカー遺伝子の発現量が高かった。即ち、高機能な肝オルガノイドの樹立にはオルガノイド培養に供する分化細胞の分化時期も最適化する必要があることが明らかとなった。
図3. Hep培地及びChol培地で樹立・培養した肝オルガノイドの比較
(A) ヒトiPS細胞由来肝細胞から肝オルガノイド樹立のプロトコル概略。(B, C)Hep培地(B)またはChol培地(C)で樹立・培養した肝オルガノイドの位相差顕微鏡像。左は低倍率(50μm)、右は高倍率(20μm)。(D)継代後0日目から18日目までの肝オルガノイドの増殖曲線。(E, F) Hep培地(E)またはChol培地(F)で数継代(0, 2, 6, 10継代)培養した肝オルガノイドにおける肝細胞マーカー遺伝子の発現量。同じ文字がない群は互いに有意に異なる(p < 0.05)。HLCs:ヒトiPS細胞由来肝細胞。(参考文献6より改変して引用)
肝オルガノイドの二次元培養とその機能評価
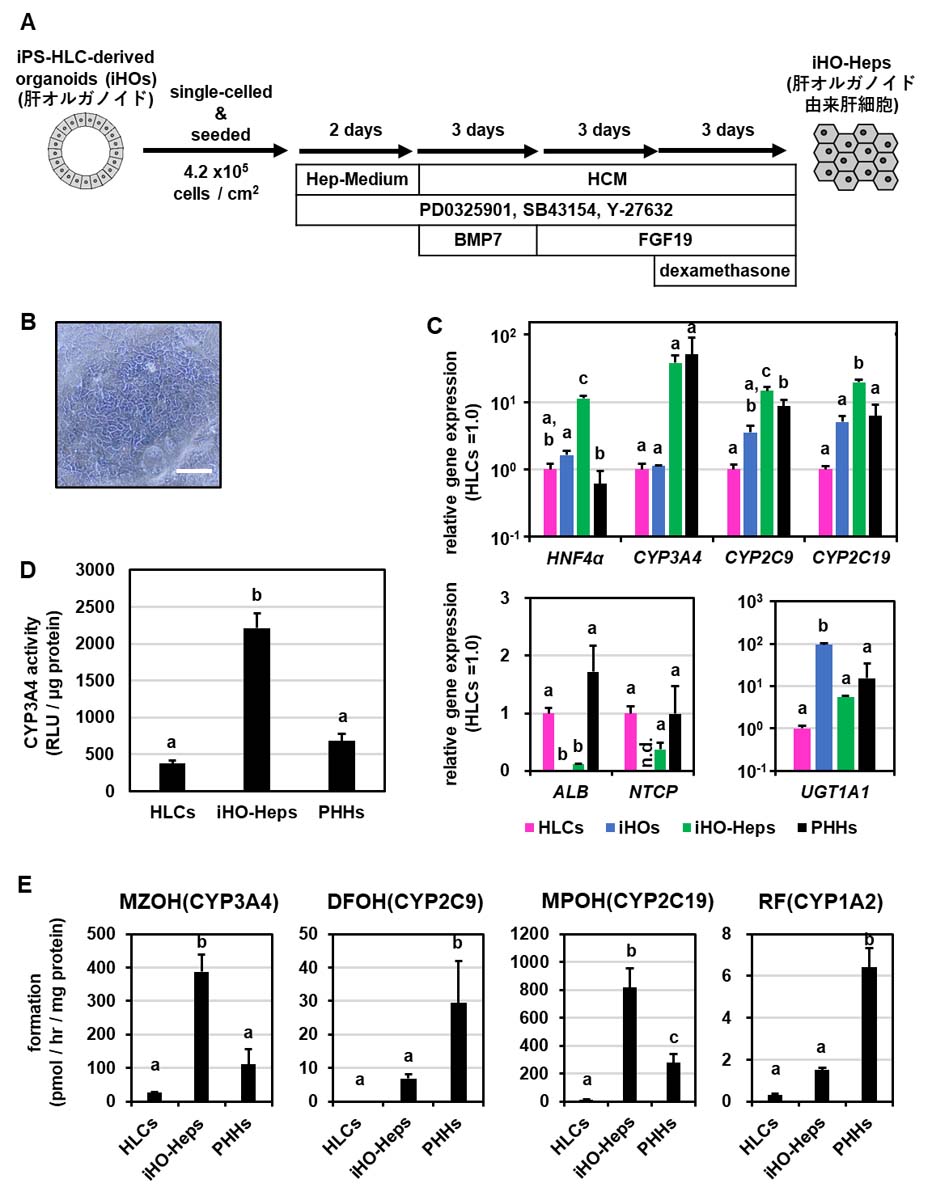
マトリゲルに包埋されたオルガノイド培養は、スループット性等の問題から利用可能な評価系が限られているため、創薬研究への応用は困難である。一方、二次元培養細胞はマルチウェルプレートでのハイスループットスクリーニングなど、既存の多くのアプリケーションに使用することが出来る。そこで我々は、肝オルガノイドの汎用性を向上させ、さらに高機能な肝細胞を作出するために、二次元培養による成熟化を試みた。我々は既に、関連する研究としてヒト初代培養肝細胞由来肝オルガノイドの二次元培養による成熟化について検討していたため[12]、その際に開発したStepwise-Mediumを用いてヒトiPS細胞由来肝オルガノイドの二次元培養を試みた(図4A)。その結果、二次元培養された肝オルガノイド由来肝細胞は、ヒトiPS細胞由来肝細胞と同様の細胞形態を示した(図4B)。肝オルガノイド由来肝細胞におけるHNF4αおよび薬物代謝酵素群の遺伝子発現量は、ヒトiPS細胞由来肝細胞、肝オルガノイド、さらにはヒト初代培養肝細胞と同等かそれ以上であった。ALB遺伝子の発現も、肝オルガノイド由来肝細胞では向上していた(図4C)。遺伝子発現の傾向と同様に、CYP3A4活性においても、肝オルガノイド由来肝細胞はヒトiPS細胞由来肝細胞やヒト初代培養肝細胞よりも有意に高く(図4D)、二次元培養された肝オルガノイド由来肝細胞が創薬研究への応用に適していることが示唆された。さらに、肝オルガノイド由来肝細胞における薬物代謝酵素群の活性を、それぞれの酵素に対する特異的基質を用いて、その代謝物をLC-MS/MSで測定することにより評価したところ、ヒトiPS細胞由来肝細胞と比較して各薬物代謝酵素活性が大幅に上昇していた。特に肝オルガノイド由来肝細胞のCYP3A4およびCYP2C19活性は、ヒト初代培養肝細胞よりも上昇していた(図4E)。
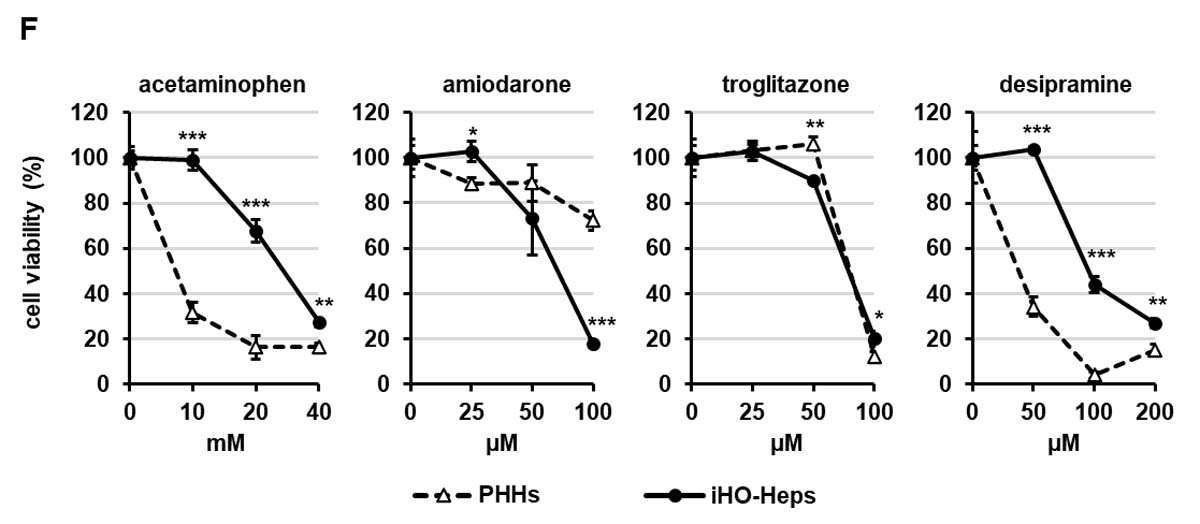
この肝オルガノイド由来肝細胞が薬物の肝毒性評価に使用できるか検討するために、肝オルガノイド由来肝細胞とヒト初代培養肝細胞を4種類の肝毒性を生じることが知られている薬物(アセトアミノフェン、アミオダロン、トログリタゾン、デシプラミン)に曝露させた。その結果、アセトアミノフェンに対する肝オルガノイド由来肝細胞の感受性は、ヒト初代培養肝細胞に比べ若干劣っていたが、アミオダロンおよびトログリタゾンに対する肝オルガノイド由来肝細胞の感受性は、ヒト初代培養肝細胞と同等かそれ以上であった(図4F)。また、CYP2D6代謝によって解毒されるデシプラミンの場合には[13]、いずれの濃度においても肝オルガノイド由来肝細胞の細胞生存率がヒト初代培養肝細胞よりも高く(図4F)、肝オルガノイド由来肝細胞のデシプラミンに対する感受性が高いことが示された。さらに、肝オルガノイド由来肝細胞はサンドイッチ培養を行うことで毛細胆管を形成し、胆汁酸排泄能を有していることも確認した。これらの結果から、肝オルガノイド由来肝細胞がヒト初代培養肝細胞と同等の薬物代謝能を有し、肝毒性評価に使用できることが示唆された。
図4. 肝オルガノイド由来肝細胞の機能解析
(A)肝オルガノイドの二次元培養プロトコルの概略。(B)肝オルガノイド由来肝細胞の位相差顕微鏡像(スケールバー:50μm)。(C)HLCs、iHO-Heps、PHHsにおける肝細胞マーカー遺伝子発現量解析。(D) HLC、iHO-Heps、PHHにおけるCYP3A4活性。 (E)ミダゾラム、ジクロフェナク、メフェニトイン、エトキシレゾルフィンの代謝物(MZOH、DFOH、MPOH、RF)をLC-MS/MS分析によって測定した各薬物代謝酵素(CYP3A4、CYP2C9、CYP2C19およびCYP1A2)の活性評価。(F) iHO-Heps、PHHsにおける4種類の薬物(acetaminophen、amiodarone、desipramineおよびtroglitazone)を用いた肝毒性評価。同じ文字がない群は互いに有意に異なる(p < 0.05)。HLCs:ヒトiPS細胞由来肝細胞、iHOs:肝オルガノイド、iHO-Heps:肝オルガノイド由来肝細胞、PHHs:ヒト初代培養肝細胞(48時間プレ培養)。(参考文献6より改変して引用)
RNA-seqによる網羅的遺伝子発現解析
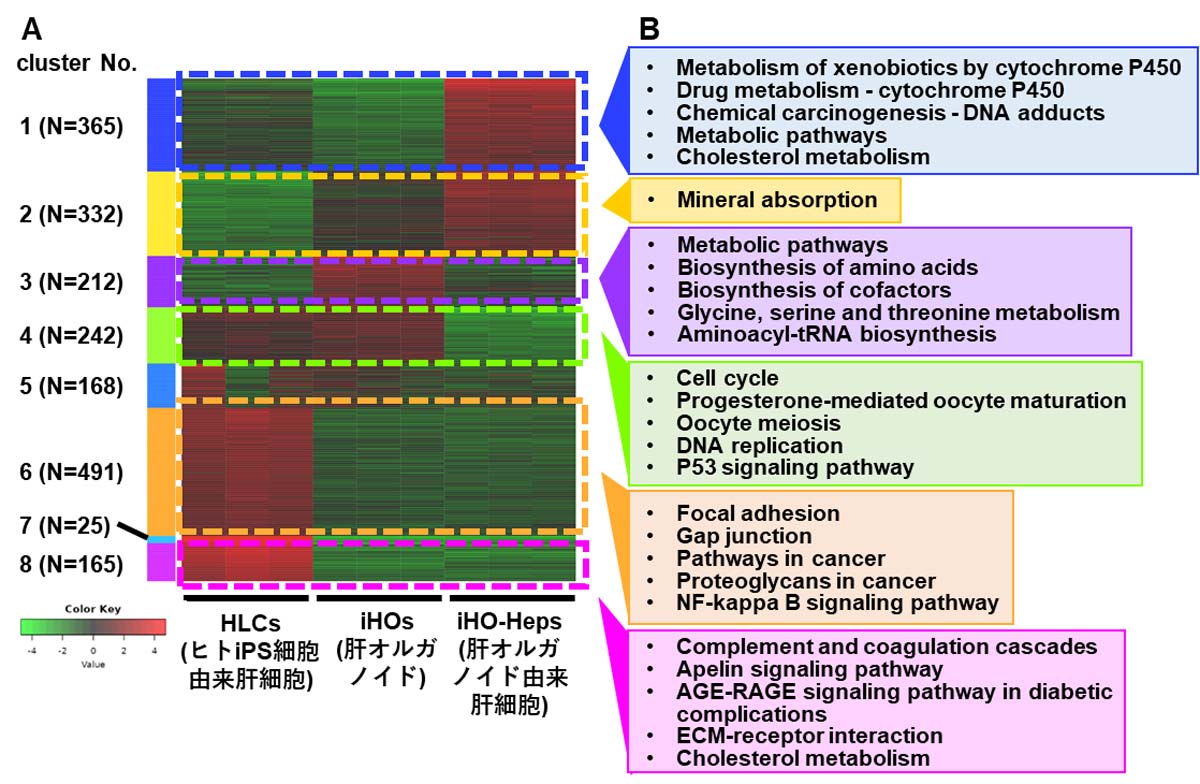
最後に培養方法の改良による網羅的な遺伝子発現への影響を調べるために、ヒトiPS細胞由来肝細胞、肝オルガノイド、および肝オルガノイド由来肝細胞のRNA-seq解析を実施した。その結果、変動パターンによって大きく8つのクラスターに分割された(図5A)。各クラスターに含まれる遺伝子を解析したところ、肝オルガノイドでは細胞増殖に関与する経路の遺伝子発現が有意に増加しており(図5B:クラスター4)、肝オルガノイド由来肝細胞では代謝に関与する遺伝子群が有意に濃縮されていた(図5B:クラスター1)。即ち、ヒトiPS細胞由来肝細胞をオルガノイド培養することで増殖能を獲得すること、さらに肝オルガノイドを肝オルガノイド由来肝細胞に分化させることで増殖能を失い肝機能が向上することが確認された。
図5. ヒトiPS細胞由来肝細胞、肝オルガノイド、および肝オルガノイド由来肝細胞のRNA-seq解析
(A)ヒートマップとk-meansクラスタリングにより可視化された、群間で最も変動が大きい上位2000遺伝子。赤は全群の平均と比較して発現が増加していることを示し、緑は発現が減少していることを示す。(B)濃縮クラスター1、2、3、4、6、8のKEGGパスウェイ解析により、上位5つのKEGGパスウェイを調整P値の小さい順に示す。すべてのパスウェイで調整P値は0.005未満であった。(参考文献6より改変して引用)
まとめ・展望
本研究では、ヒトiPS細胞由来肝細胞の課題を克服し、オルガノイド培養により細胞増殖能を付与させ、さらにStepwise-Mediumを用いた二次元培養によって、肝オルガノイドを機能的な肝細胞へと成熟させ、同細胞の創薬研究における有用性を実証した。これにより、医薬品候補化合物の薬物動態や毒性を効率的かつ正確に予測できるようになるだけでなく、患者由来iPS細胞やゲノム編集iPS細胞[14-18]から樹立された肝オルガノイドを用いることで、遺伝性肝疾患の病態解明や特異体質性肝毒性の予測も可能になると期待される。さらに本稿の肝オルガノイドは、高機能な肝細胞を大量に供給できるため、将来的には肝細胞移植などの再生医療への応用も期待される。
謝辞
本稿で紹介した成果は、大阪大学大学院薬学研究科分子生物学分野の教員・学生の方々の協力によって得られたものです。関係者の皆様には改めてここに感謝の意を表します。
参考文献
- Takayama K. et al., Prediction of drug-induced liver injury by using human pluripotent stem cell-derived hepatocyte-like cells. Drug. Metab. Pharmacokinet. 32, 12-20 (2017).
- Deguchi S. et al., Generation of human induced pluripotent stem cell-derived hepatocyte-like cells for cellular medicine. Biol. Pharm. Bull. 43, 608-615 (2020).
- Takayama, K. et al., Prediction of interindividual differences in hepatic functions and drug sensitivity by using human iPS-derived hepatocytes. Proc. Natl. Acad. Sci. U. S. A. 111, 16772–16777 (2014).
- Baxter, M., et al., Phenotypic and functional analyses show stem cell-derived hepatocyte-like cells better mimic fetal rather than adult hepatocytes. J. Hepatol. 62, 581-589 (2015).
- Berger, D.R. et al., Enhancing the functional maturity of induced pluripotent stem cell-derived human hepatocytes by controlled presentation of cell-cell interactions in vitro. Hepatology 61, 1370-1381 (2015).
- Inui, J. et al., Two-dimensionally cultured functional hepatocytes generated from human induced pluripotent stem cell-derived hepatic organoids for pharmaceutical research. Biomaterials 318, 123148 (2025).
- Marsee, A. et al., Building consensus on definition and nomenclature of hepatic, pancreatic, and biliary organoids. Cell Stem Cell 28, 816–832 (2021).
- Huch, M. et al., Long-term culture of genome-stable bipotent stem cells from adult human liver. Cell. 160, 299-312 (2015).
- Hu, H. et al., Long-term expansion of functional mouse and human hepatocytes as 3D organoids. Cell 175, 1591-1606.e19 (2018).
- Kim, H. et al., Development of human pluripotent stem cell-derived hepatic organoids as an alternative model for drug safety assessment. Biomaterials 286, 121575 (2022).
- Shinozawa, T. et al., High-fidelity drug-induced liver injury screen using human pluripotent stem cell–derived organoids. Gastroenterology 160, 3, 831-846.e10. (2021)
- Ueyama-Toba, Y. et al., Development of a two-dimensional hepatic differentiation method from primary human hepatocyte-derived organoids for pharmaceutical research. iScience 27, 110778 (2024).
- Spina, E. et al., Relationship between plasma desipramine levels, CYP2D6 phenotype and clinical response to desipramine: A prospective study. Eur. J. Clin. Pharmacol. 51, 395–398 (1997).
- Deguchi, S. et al., In vitro model for a drug assessment of cytochrome P450 family 3 subfamily a member 4 substrates using human induced pluripotent stem cells and genome editing technology. Hepatol. Commun. 5, 1385–1399 (2021).
- Ghodsizadeh, A. et al., Generation of liver disease-specific induced pluripotent stem cells along with efficient differentiation to functional hepatocyte-like cells. Stem Cell Rev. Reports. 6, 622–632 (2010).
- Jing, R. et al., A screen using iPSC-derived hepatocytes reveals NAD+ as a potential treatment for mtDNA depletion syndrome. Cell Rep. 25, 1469-1484.e5 (2018).
- Cayo, M. A. et al., A drug screen using human iPSC-derived hepatocyte-like cells identifies cardiac glycosides as a potential treatment for hypercholesterolemia. Cell Stem Cell 20, 478 (2017).
- Deguchi, S. et al., Modeling of hepatic drug metabolism and responses in CYP2C19 poor metabolizer using genetically manipulated human iPS cells. Drug Metab. Dispos. 47, 632–638 (2019).