研究交流
ヒト胆汁酸型マウスを用いた新規胆汁うっ滞症in vivoモデル系の開発
東海大学・医学部医学科・基礎医学系分子生命科学領域
紙谷聡英
はじめに
胆汁は、胆汁酸・コレステロール・リン脂質などを主成分とし、肝細胞から排泄され微小胆管・肝内胆管を通じて肝外へと輸送された後に、胆のうを経由して小腸へと分泌される。小腸における胆汁は、食事由来の脂質のミセル化を通じて消化吸収を補助している。特に、コレステロールを原料に肝細胞で合成される一次胆汁酸であるコール酸(CA)・ケノデオキシコール酸(CDCA)、および小腸の腸内細菌によって一次胆汁酸が代謝された二次胆汁酸のリトコール酸(LCA)、デオキシコール酸(DCA)は、その疎水的な作用によって脂質のミセル化に重要である(1)。一方で、胆汁酸の疎水的性質は細胞毒性をもたらすため、胆管の閉鎖や肝細胞の胆汁トランスポーターの遺伝子変異などで胆汁うっ滞が生じると、肝細胞死を伴う肝傷害を誘導し肝硬変などの重篤な肝疾患につながる。例えば、肝細胞から胆汁へ胆汁酸やリン脂質を排出するトランスポーターなどの遺伝子変異は、家族性肝内胆汁うっ滞症(PFIC)の原因となり、血清直接ビリルビン、総胆汁酸及び血清肝傷害マーカー(AST・ALT)の高値などの症状を呈する(2, 3)。
これらの遺伝子欠損マウスが、PFICモデル動物として作製・解析されている(4, 5)。しかし、マウスで生じる肝傷害はヒトPFICと比較して症状が軽減しており、原因として胆汁酸組成の種差の関与が想定された(6, 7)。マウス肝臓ではヒトにはない独自の胆汁酸代謝酵素(Cyp2a12, Cyp2c70)が発現し、疎水性の高い2次胆汁酸を1次胆汁酸に変換する、また親水性のミュリコール酸(MCA)を合成する機能を持っている。このためマウスはヒトよりも親水性の高い胆汁酸組成を持っており、胆汁うっ滞時の細胞毒性が低いと想定された。Cyp2a12/Cyp2c70二重欠損(CYPDKO)マウスは、ほとんど胆汁内にMCAが存在せず、ヒトに類似した胆汁酸組成を持っている(8)。そこで本研究では、CYPDKOマウスに外来的にPFIC原因遺伝子の変異を誘導することで、よりヒト疾患に近いPFICモデル動物の作製を目的とした。
アデノ随伴ウイルス(AAV)を用いた迅速な肝特異的遺伝子改変法
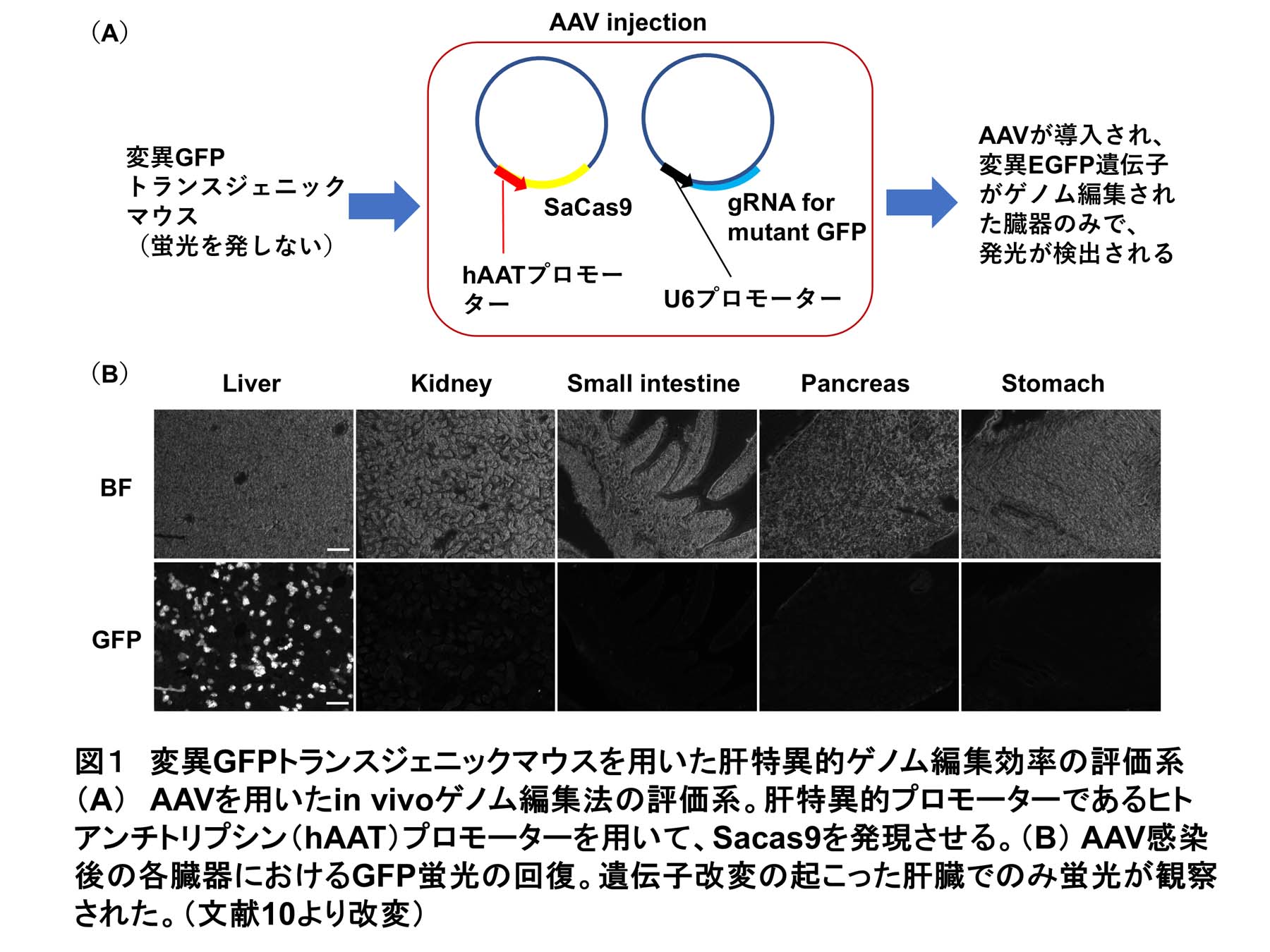
成体マウス個体に外来的に遺伝子変異を誘導する方法として、本研究ではAAVによるin vivoゲノム編集法を用いた。In vivoゲノム編集効率を解析する方法として、変異EGFPマウスを用いた評価法が構築されている(9)。内部にストップコドンを持つ変異EGFP遺伝子を挿入されたトランスジェニックマウスに、Cas9および変異EGFPに対するgRNAを遺伝子導入すると、ストップコドン周囲にゲノム編集が生じてEGFP活性が回復した細胞でのみ蛍光が見られる。このEGFP活性の回復を指標として、in vivoゲノム編集効率を評価する。肝臓に感染性の高いAAV8をキャプシドタンパク質として用いて、ヒトアンチトリプシンプロモーターによって肝臓特異的にSaCas9を発現させた。さらにヒトU6プロモーターを用いてgRNAを導入した結果、肝臓でのみ特異的にEGFP活性の回復が見られ、外来的に肝特異的なゲノム編集が誘導できることを見出した(10)(図1)。
ヒト胆汁酸モデルマウスを用いたPFIC3病態モデルの構築
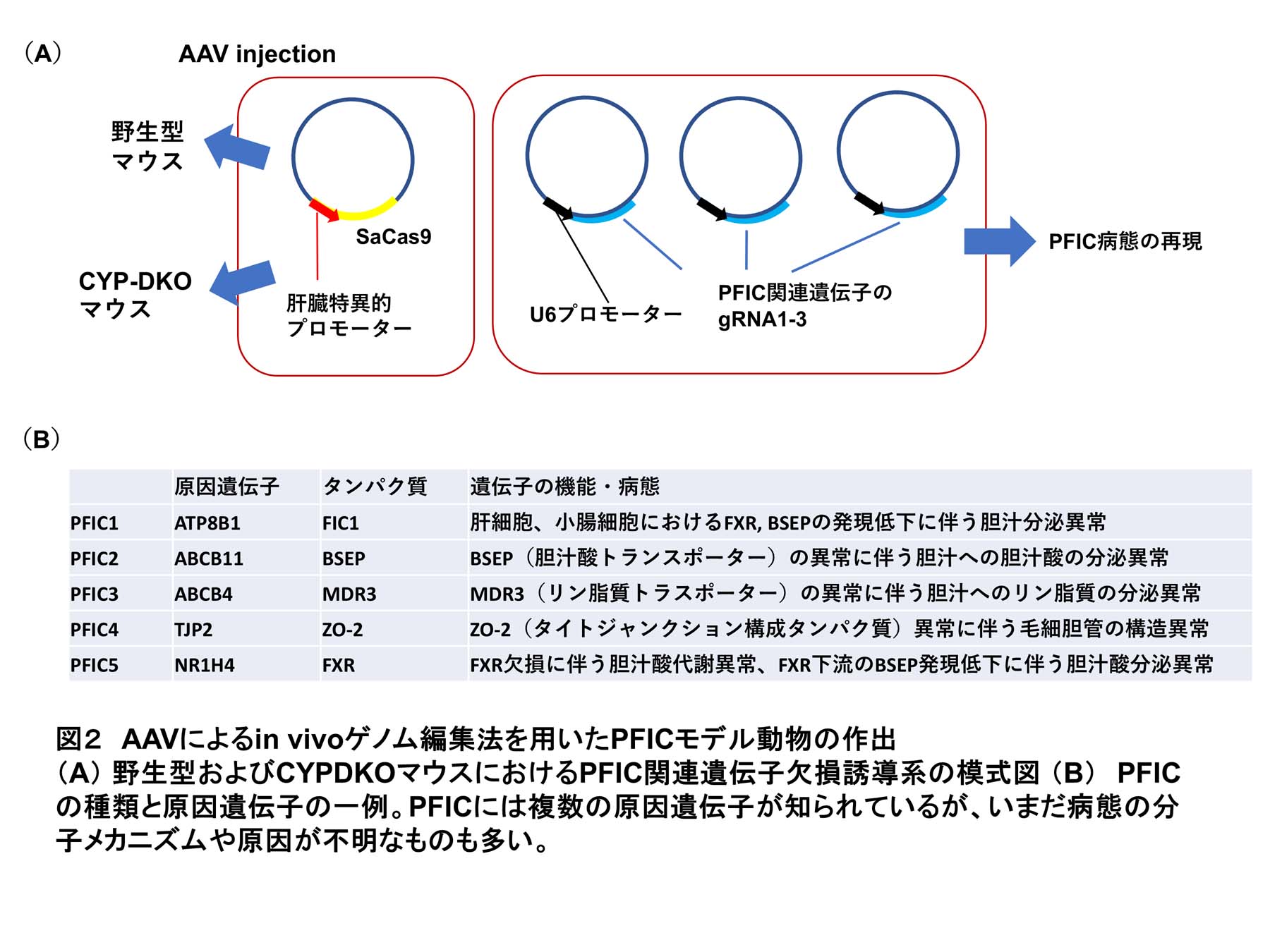
上記の系を用いることで、既存の遺伝子改変動物に対して、追加の遺伝子変異を迅速に誘導することが可能である。そこで、CYPDKOマウスにPFIC1〜5の各原因遺伝子の欠損を誘導し、胆汁うっ滞の病態の網羅的な解析を行っている(図2)。
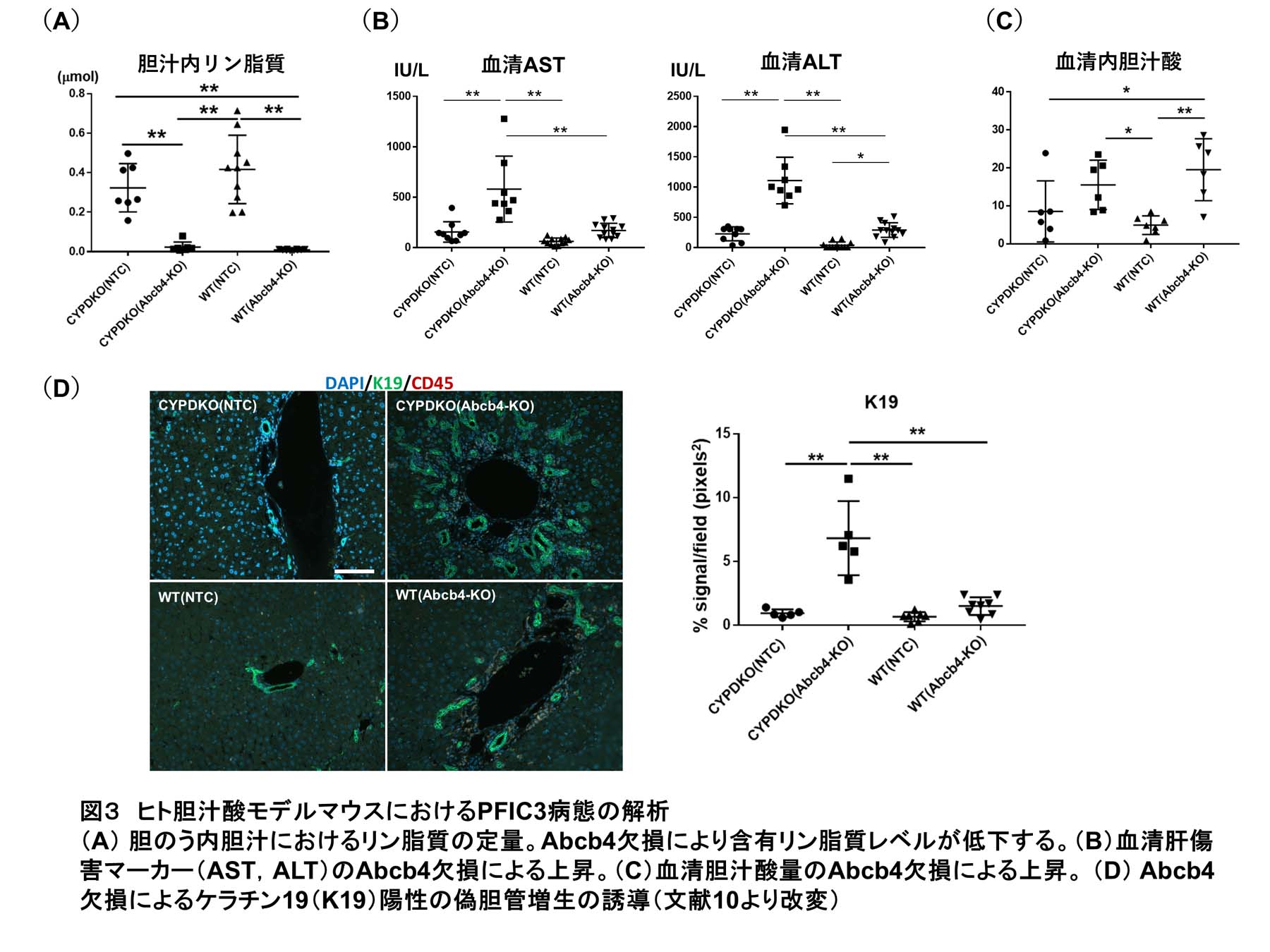
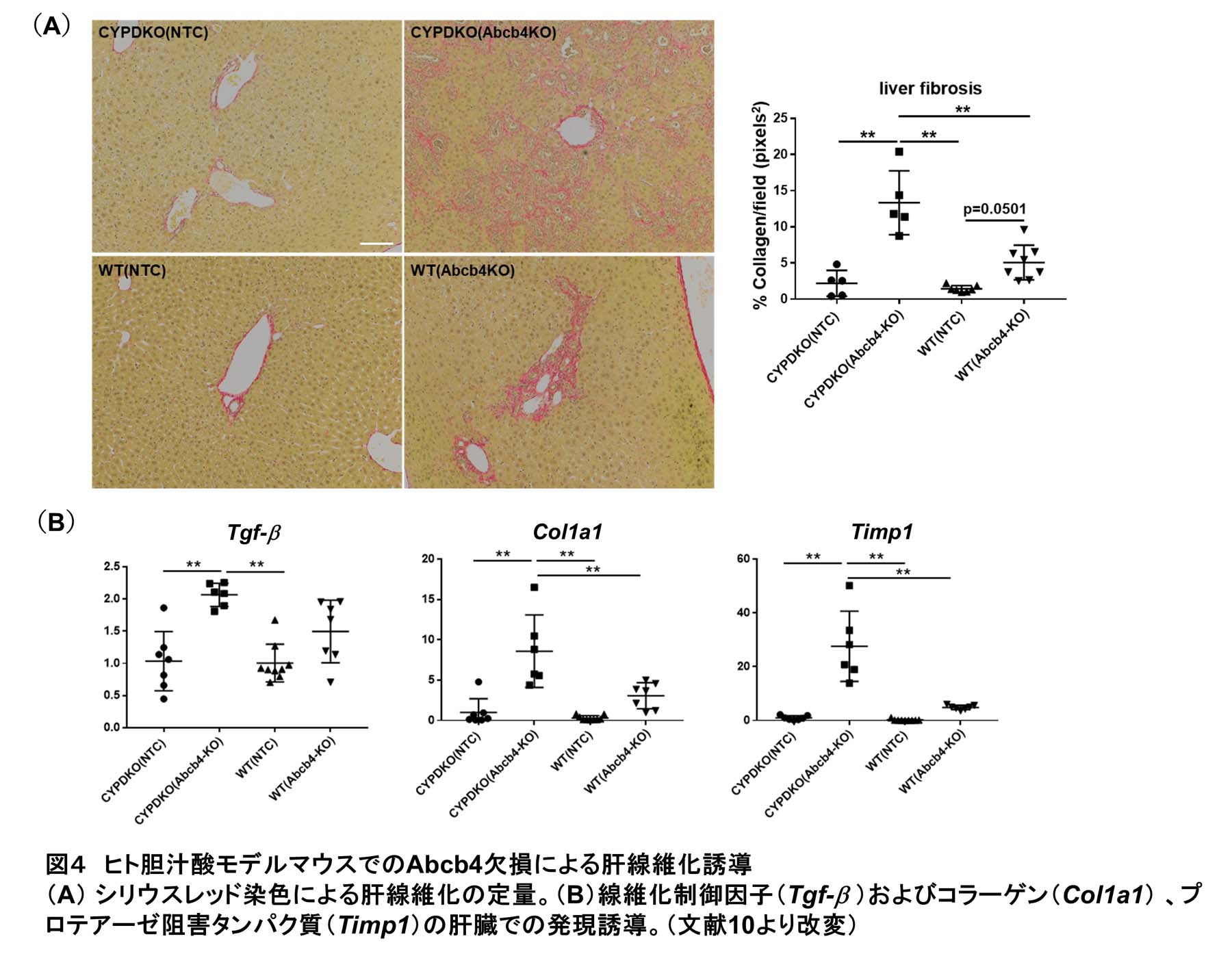
その一つであるAbcb4は肝細胞が分泌する胆汁へとリン脂質を輸送する膜タンパク質である。その欠損は、リン脂質濃度低下を通じて胆汁の細胞毒性を増加させ、PFIC3の原因となる。そこで、野生型C57BL/6(WT)マウスおよびCYPDKOマウスにAAVを用いてSaCas9およびAbcb4gRNAを導入し、遺伝子欠損による病態を解析した。その結果、どちらのマウスでもAbcb4欠損による胆汁内リン脂質濃度の著しい低下が見られ、この遺伝子改変系によりAbcb4の機能欠損を効率的に誘導できた(図3A)。WT/Abcb4欠損マウスでは血清胆汁酸値の上昇や血清肝傷害マーカーのmildな上昇が見られ、既報のAbcb4ノックアウトマウスと同様の胆汁うっ滞肝傷害が観察された。一方でCYPDKO/Abcb4欠損マウスでは著しく強い血清肝傷害マーカー誘導が見られ、組織切片の解析でもケラチン19陽性の偽胆管細胞の増殖や血液細胞浸潤が強く誘導された(図3B-D)。これらの結果と一致してCYPDKO/Abcb4欠損マウスでは、シリウスレッド陽性の肝線維化が亢進しており、線維化関連遺伝子の肝臓での発現誘導も観察された(図4)。肝臓に含まれる各胆汁酸の定量解析を行った結果、肝内における胆汁酸の総量はWT, CYPDKOマウスともにAbcb4欠損によって上昇し、どちらのマウスでも肝内胆汁うっ滞が生じている。一方で、その胆汁酸組成は大きく異なっており、WTマウスでは親水性のMCAが大部分を占めるのに対し、CYPDKOマウスではCDCAやLCAといった疎水性の胆汁酸が多く含まれ、結果として胆汁酸全体の疎水性が非常に高値になっている。この胆汁酸組成の差が高い細胞毒性につながり、CYPDKO/Abcb4欠損マウスでの肝傷害や線維化誘導につながると考えられた。
まとめ
以上の結果から、Abcb4欠損による胆汁うっ滞では、肝傷害誘導に胆汁酸組成の種差が重要な役割を果たしていることを見出した(10)。胆汁うっ滞を伴う肝疾患として、肝細胞における胆汁酸関連トランスポーターやその調節因子の変異によるPFICに加えて、胆管分化を制御する転写因子の変異によるアラジール症候群、自己免疫疾患による胆管傷害(原発性胆汁性胆管炎・原発性硬化性胆管炎)などがある(11)。このような疾患は、重篤なケースでは現在の抜本的な治療法としては肝移植が中心であり、新たな治療法の開発が望まれている。しかし上述のように、マウスとヒトの胆汁酸組成の種差の問題から、通常のマウスをベースにした病態モデルでは、胆汁うっ滞による肝傷害をヒトと同様のレベルで再現できず、治療法の開発などに障害となる可能性がある。本研究ではヒト胆汁酸モデルマウスの有用性を示し、よりヒトに近い胆汁うっ滞モデルの構築や解析への応用が期待できる。
(参考文献)
- Fuchs CD, Simbrunner B, Baumgartner M, Campell C, Reiberger T, and Trauner M. Bile acid metabolism and signaling in liver disease. J Hepatol. 2024.
- Bull LN, and Thompson RJ. Progressive Familial Intrahepatic Cholestasis. Clin Liver Dis. 2018;22(4):657-69.
- Pfister ED, Droge C, Liebe R, Stalke A, Buhl N, Ballauff A, et al. Extrahepatic manifestations of progressive familial intrahepatic cholestasis syndromes: Presentation of a case series and literature review. Liver Int. 2022;42(5):1084-96.
- Fickert P, Fuchsbichler A, Wagner M, Zollner G, Kaser A, Tilg H, et al. Regurgitation of bile acids from leaky bile ducts causes sclerosing cholangitis in Mdr2 (Abcb4) knockout mice. Gastroenterology. 2004;127(1):261-74.
- Lammert F, Wang DQ, Hillebrandt S, Geier A, Fickert P, Trauner M, et al. Spontaneous cholecysto- and hepatolithiasis in Mdr2-/- mice: a model for low phospholipid-associated cholelithiasis. Hepatology. 2004;39(1):117-28.
- Thakare R, Alamoudi JA, Gautam N, Rodrigues AD, and Alnouti Y. Species differences in bile acids I. Plasma and urine bile acid composition. J Appl Toxicol. 2018;38(10):1323-35.
- Rudling M. Understanding mouse bile acid formation: Is it time to unwind why mice and rats make unique bile acids? J Lipid Res. 2016;57(12):2097-8.
- Honda A, Miyazaki T, Iwamoto J, Hirayama T, Morishita Y, Monma T, et al. Regulation of bile acid metabolism in mouse models with hydrophobic bile acid composition. J Lipid Res. 2020;61(1):54-69.
- Miura H, Imafuku J, Kurosaki A, Sato M, Ma Y, Zhang G, et al. Novel reporter mouse models useful for evaluating in vivo gene editing and for optimization of methods of delivering genome editing tools. Mol Ther Nucleic Acids. 2021;24:325-36.
- Tsuruya K, Yokoyama K, Mishima Y, Ida K, Araki T, Ieda S, et al. Abcb4-defect cholangitis mouse model with hydrophobic bile acid composition by in vivo liver-specific gene deletion. J Lipid Res. 2024;65(9):100616.
- Squires JE, and McKiernan P. Molecular Mechanisms in Pediatric Cholestasis. Gastroenterol Clin North Am. 2018;47(4):921-37.