研究交流
iPS細胞由来肝細胞系譜細胞を用いたB型肝炎ウイルス感染培養系の構築
金子 俊1)、柿沼 晴1,2)、朝比奈 靖浩1,2)
1)東京医科歯科大学消化器内科 2)東京医科歯科大学大学院肝臓病態制御学
はじめに
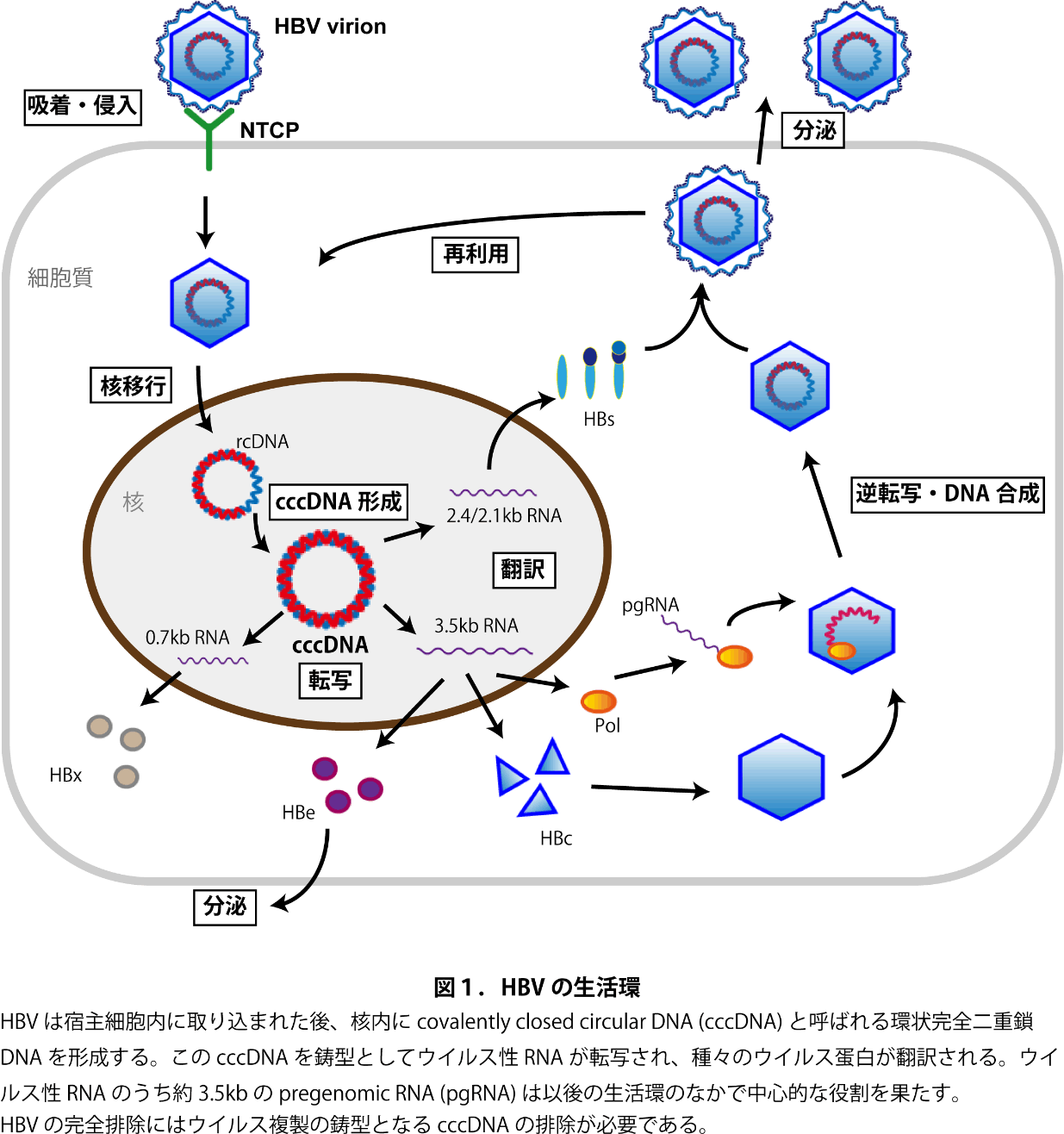
B型肝炎ウイルス(HBV)は世界的に蔓延する感染症であり、約2億4千万人が持続感染し、肝硬変や肝癌の原因となっている。近年は核酸アナログ治療により、ウイルス複製の抑制が可能にはなったが、現存の治療ではウイルス複製の鋳型となるHBV covalently closed circular DNA(cccDNA)を完全排除し、ウイルスを体内から排除することは極めて困難である(図1参照)。従って、依然としてHBVは難治疾患であり、ウイルス完全排除を可能とする治療戦略の開発が期待されている。
ウイルス感染・排除の過程を再現しうるin vitroでのHBV感染培養系は、これまでHBVが感染できる宿主細胞が少なく、主に初代培養ヒト肝細胞、及び近年同定されたHBV侵入受容体sodium taurocholate cotransporting polypeptide(NTCP)を強制発現した肝癌細胞株(HepG2-NTCP)などが用いられてきた。しかし、初代培養ヒト肝細胞は、樹立にドナー肝組織が必要で汎用化が難しく、しかも培養による急速な機能低下があり、長期培養が不可能である。一方、肝癌細胞株では自然免疫や代謝機能が正常肝細胞とは著しく異なるという問題がある。HBV感染・排除機構を研究するためには、これらの点を克服しうる感染培養系の構築が必要である。そのために我々は、ヒトiPS細胞から誘導した肝細胞系譜細胞を用いたHBV感染培養系を構築し1、創薬研究を進めている。本稿ではHBV感染培養系の現状と、iPS由来肝細胞系譜細胞の分化・成熟度、免疫応答の観点から、既存の感染培養系と比較した有用性に関して概説したい。
NTCP(sodium taurocholate cotransporting polypeptide)
NTCPはSLC10Aファミリーに属するNa依存性胆汁酸トランスポーターである。肝細胞の基底膜側に存在し、抱合胆汁酸や門脈血からの薬物輸送等に関与するとされている。本分子はHBV large surface proteinのPreS1領域と特異的に結合し、HBV侵入受容体として機能する事が近年の研究で判明した2。
これまで、一般的な肝癌細胞株(HepG2、Huh7等)では、通常の培養法ではHBV感染を許容する事はなく、研究進展の大きな障害となっていた。そこでNTCPを恒常的に発現した肝癌細胞株が樹立され、特にHBVに高い感染許容性を示す細胞クローン(HepG2-NTCP-C4細胞)3も樹立されるなど、in vitroでの感染培養系研究の進展がみられるようになった。また、NTCPを介したHBV侵入阻害薬としてPreS1 peptide, Myrcludex B®(a synthetic N-acylated preS1 lipopeptide)が開発され4、さらに免疫抑制活性のないシクロスポリン誘導体の強力な抗HBV効果が報告される5など、HBV侵入阻害薬の臨床応用にむけた研究が進められている。
ヒトiPS細胞由来肝細胞系譜細胞におけるHBVの感染性の証明
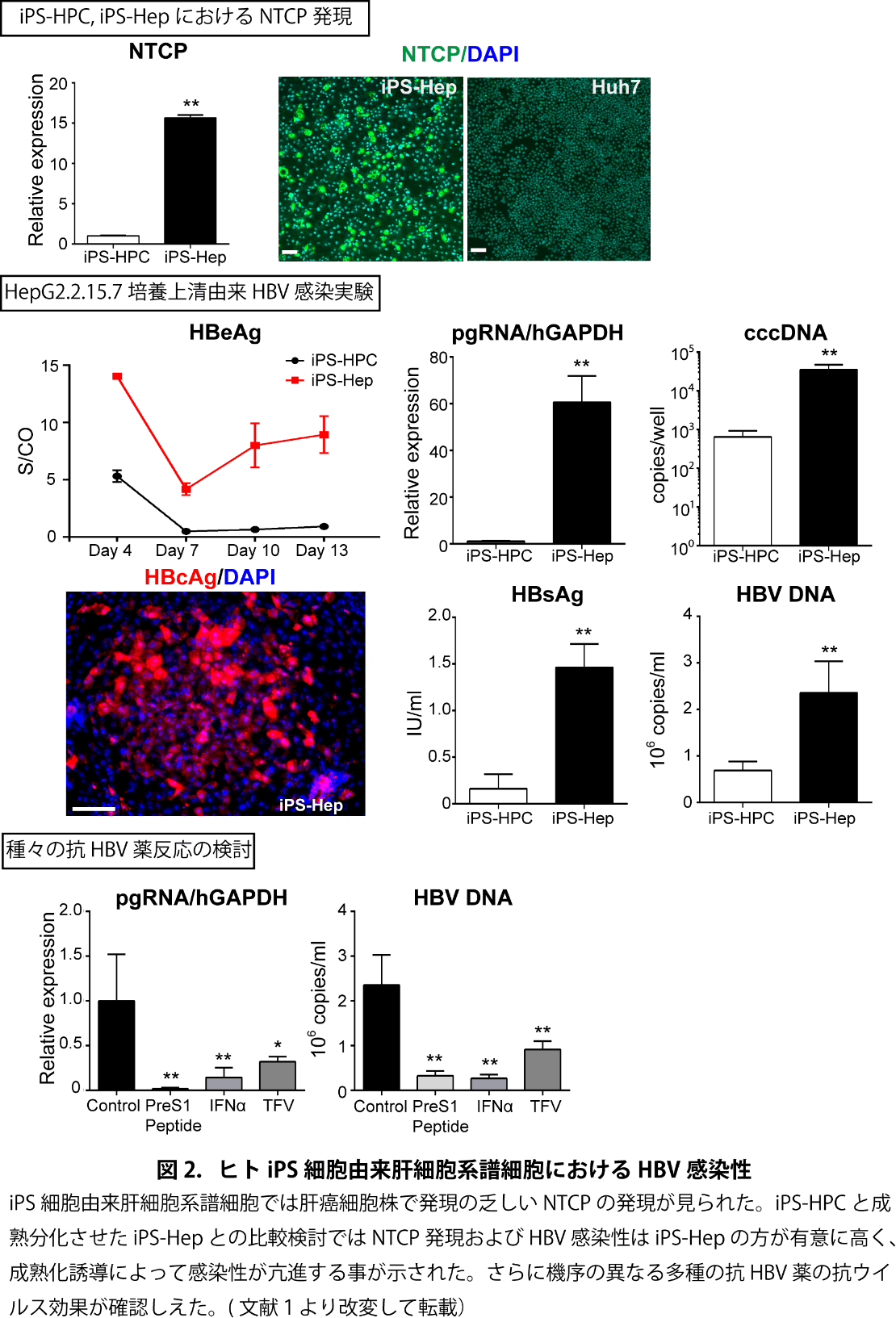
我々は東海大学 紙谷聡英先生らとの共同研究により、ヒトiPS細胞株から肝細胞系譜へと誘導した後にCD13/CD133陽性画分をFACSにより濃縮し、iPS由来肝幹/前駆様細胞(iPS-HPC)を株化して培養した6, 7。さらにhOSM添加後も培養継続し成熟分化させたiPS由来肝細胞様細胞(iPS-Hep)を誘導し、これらを宿主細胞として使用し、HBV感染培養系の構築を試みた。 Luciferase発現型組み換えHBV(HBV/NL)8、 HBV恒常発現株HepG2.2.15.7細胞由来培養上清9、および1.2倍長HBV発現plasmidを用いて、宿主細胞におけるHBVの感染性とウイルス粒子産生能を検討した。iPS-HPCではhepatoblast に発現するAFP、HNF4α、CK7、ALBの発現がみられ、Feeder細胞(MEF)上で、3か月間以上の長期間、安定した培養が可能であった。本細胞では、肝癌細胞株に比べ有意に高いNTCPの発現を認めた。HBV/NL及びHepG2.2.15.7由来HBVの感染を検討すると、感染許容性が示された。また、HBV DNA発現plasmidをtransfectionして、ウイルス複製能を検討したところ、細胞内のHBV DNA複製とHBV関連抗原の培養上清への産生がみられ、これが既存のHBV複製阻害薬により阻害される事が示された。次に、成熟分化させたiPS-HepとiPS-HPCとの比較検討では肝細胞成熟化マーカー、NTCP発現およびHBV感染性はiPS-Hepの方が有意に高く、成熟化誘導によって感染性が亢進する事が示された(図2)。さらにInterferon(IFN)α、核酸アナログ(tenofovir, TFV)、PreS1 Peptideと異なった機序の抗HBV薬の抗ウイルス効果がそれぞれ確認しえた。
iPS-HPC/iPS-Hepは自然免疫応答を保持する
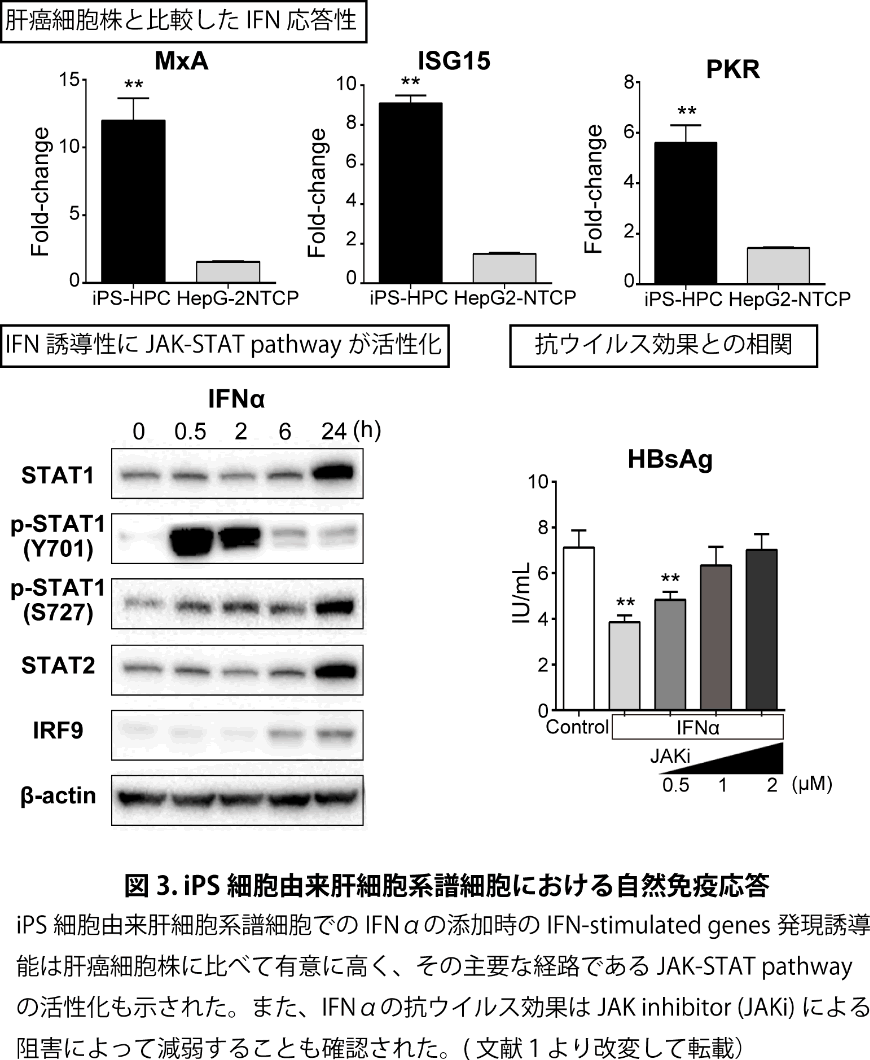
HBV排除機構には自然免疫反応は重要な役割を果たすことが知られている10。前述のようにNTCPを強制発現した肝癌細胞株でもHBV感染実験が行えるようになったが、TypeⅠinterferon(IFN)関連の自然免疫応答において重要な経路が欠損しているため正確なウイルス宿主相互作用の解析には困難な点がある11, 12。
我々が用いたiPS細胞由来肝細胞系譜細胞での自然免疫応答に関して比較すると、IFNαの添加時のIFN-stimulated genes発現誘導能は肝癌細胞株に比べて有意に高く、その主要な経路であるJAK-STAT pathwayの活性化も確認された(図3)。また、抗ウイルス効果に関してはJAK inhibitor(JAKi)による阻害によって減弱することも示され、既報13, 14も併せて、多能性幹細胞由来の肝細胞系譜細胞では自然免疫応答が保持されている事が示された。
成熟化と遺伝子改変技術の応用
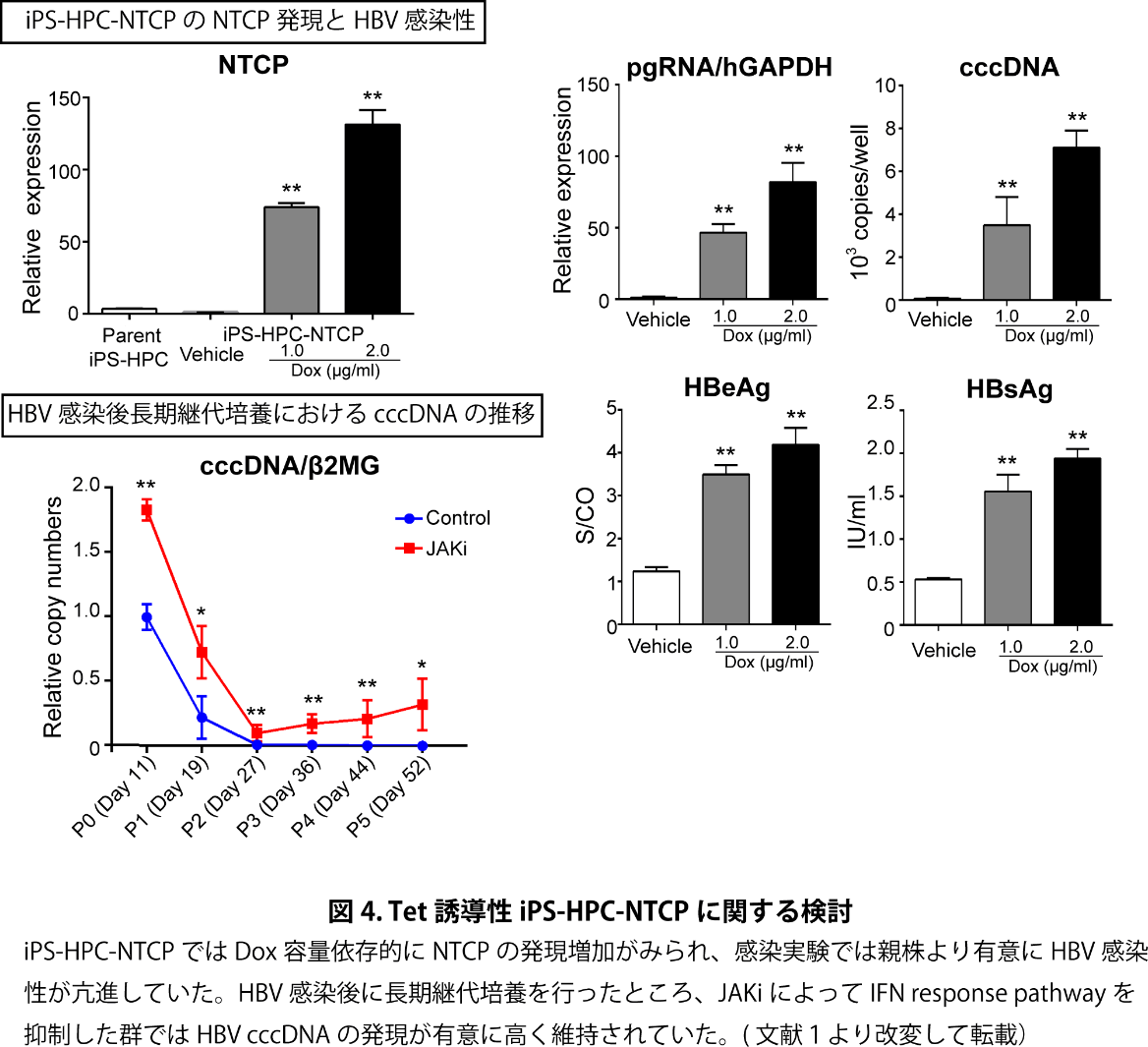
iPS-Hepでは成熟化の進行と増殖の停止に伴い、長期維持培養が困難であり、感染後長期間のウイルス動態を観察する事はできなかった。そこで、感染性は比較的低いが長期培養も可能であるiPS-HPCにおいて、侵入受容体NTCPをTetracyclin(Tet)誘導性に強制発現できるiPS-HPC-NTCP株を樹立した。このiPS-HPC-NTCPではDox容量依存的にNTCPの発現増加がみられ、感染実験では親株より有意にHBV感染性が亢進していた(図4)。さらに前記の種々の機序の抗HBV薬効果も確認された。iPS-HPC-NTCPは自然免疫応答の維持された長期培養可能なHBV感染性細胞であり、HBV感染後に長期継代培養を行ったところ、JAKiによってIFN response pathwayを抑制した群ではHBV cccDNAの発現が有意に高く維持された。これらの結果より、HBV cccDNAの長期維持には自然免疫応答の制御が関与している事が示唆された。
まとめと展望
本研究によりiPS-HPCのHBV感染培養系における有用性が初めて示された。iPS細胞から肝細胞様細胞への誘導法としては4-step protocol が報告され15、広く用いられているが、本手法は誘導に数週間が必要で、さらに誘導過程で不規則に間葉系細胞へ分化した細胞が混入してしまう不安定さがみられた。しかし、本研究ではCD13 /CD133で純化し、継代培養したiPS-HPCを用いる事で安定した表現系を確保し、そして検出感度が高いHBV/NLも用いる事で、初めてhepatoblast stageも含めた肝細胞成熟化とHBV感染性の関係、複製過程の詳細な解析が可能になった。iPS由来肝細胞系譜細胞では自然免疫応答反応が肝癌細胞株より有意に保持されている事も示され、既存の様々な機序の抗ウイルス薬反応を確認する事ができた。また、その上で遺伝子改変技術を用いた事で長期培養可能で感染効率も担保されるiPS-HPC-NTCPを樹立し、感染後に長期培養を行うとcccDNAの維持された潜伏感染の培養系での再現ができ、cccDNAの維持には自然免疫応答の制御が重要である知見が得られた。
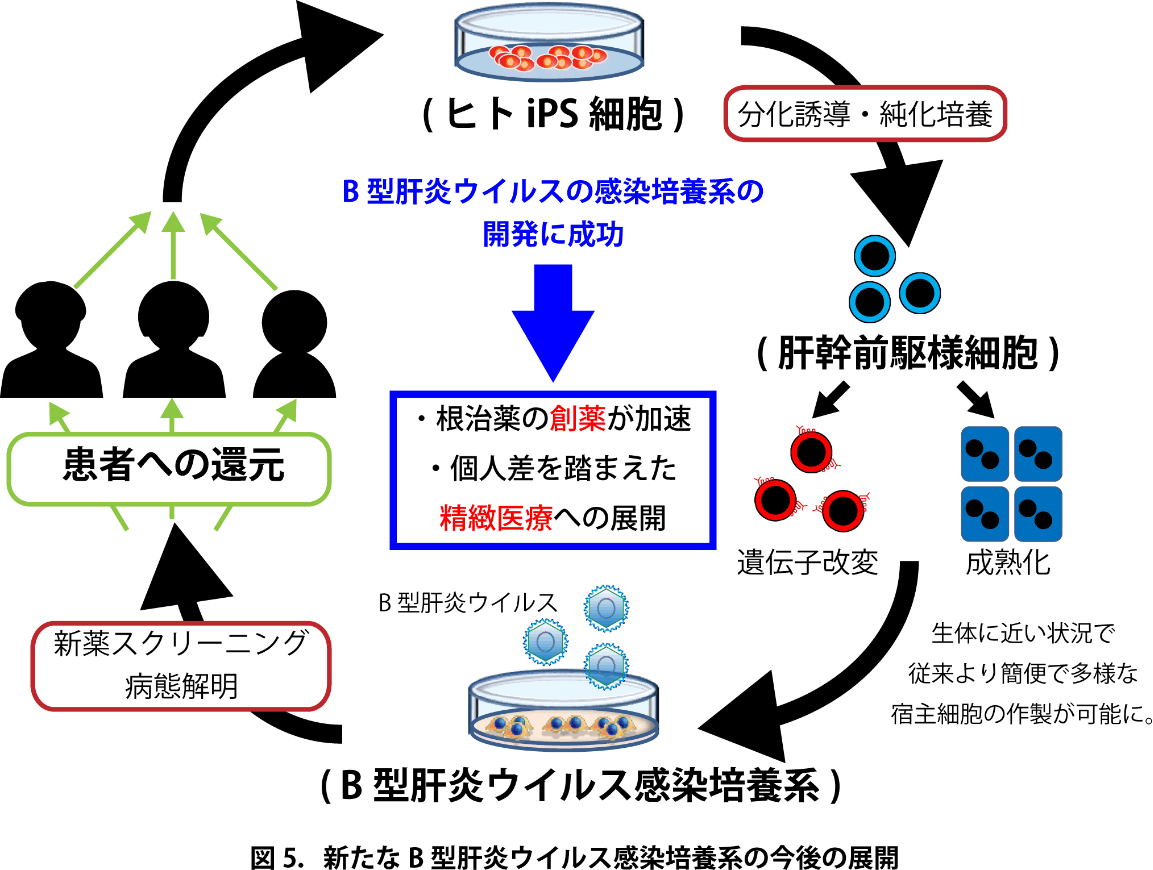
iPS由来細胞の樹立にはヒト肝組織を必要としないという大きな利点がある。これを用いた今後の研究の進展として、自然免疫応答の維持された宿主細胞としての薬物スクリーニング、宿主・ウイルス間相互作用の解明によるHBV cccDNAの完全排除を目指した創薬研究、既存の細胞では困難であった遺伝的多様性に合わせた精緻な検討、初代培養肝細胞では困難なゲノム編集技術を用いた解析、細胞分化・成熟化の視点からみたHBV持続感染に関与する因子に関する検討、といった新たな治療戦略を指向する研究への新展開が、今後期待できると考えられる(図5)。
謝辞
最後に本研究は、東海大学 紙谷聡英先生、東京大学医科学研究所 中内啓光先生、国立国際医療研究センター 下遠野邦忠先生、国立感染症研究所 渡士幸一先生、脇田隆字先生をはじめ、多くの共同研究者の先生方との共同研究であることを申し添えます。共同研究者の先生方、当教室の渡辺守教授、教室のメンバーにこの場をお借りして深く感謝申し上げます。
参考文献
- Kaneko S, Kakinuma S, Asahina Y, et al. Human induced pluripotent stem cell-derived hepatic cell lines as a new model for host interaction with hepatitis B virus. Sci Rep 2016;6:29358.
- Yan H, Zhong G, Xu G, et al. Sodium taurocholate cotransporting polypeptide is a functional receptor for human hepatitis B and D virus. Elife 2012;1:e00049.
- Iwamoto M, Watashi K, Tsukuda S, et al. Evaluation and identification of hepatitis B virus entry inhibitors using HepG2 cells overexpressing a membrane transporter NTCP. Biochem Biophys Res Commun 2014;443:808-13.
- Urban S, Bartenschlager R, Kubitz R, et al. Strategies to inhibit entry of HBV and HDV into hepatocytes. Gastroenterology 2014;147:48-64.
- Watashi K, Sluder A, Daito T, et al. Cyclosporin A and its analogs inhibit hepatitis B virus entry into cultured hepatocytes through targeting a membrane transporter, sodium taurocholate cotransporting polypeptide(NTCP). Hepatology 2014;59:1726-37.
- Yanagida A, Ito K, Chikada H, et al. An in vitro expansion system for generation of human iPS cell-derived hepatic progenitor-like cells exhibiting a bipotent differentiation potential. PLoS One 2013;8:e67541.
- Kakinuma S, Ohta H, Kamiya A, et al. Analyses of cell surface molecules on hepatic stem/progenitor cells in mouse fetal liver. J Hepatol 2009;51:127-38.
- Nishitsuji H, Ujino S, Shimizu Y, et al. A novel reporter system to monitor early stages of the HBV life cycle. Cancer Sci 2015.
- Ogura N, Watashi K, Noguchi T, et al. Formation of covalently closed circular DNA in Hep38.7-Tet cells, a tetracycline inducible hepatitis B virus expression cell line. Biochem Biophys Res Commun 2014;452:315-21.
- Belloni L, Allweiss L, Guerrieri F, et al. IFN-alpha inhibits HBV transcription and replication in cell culture and in humanized mice by targeting the epigenetic regulation of the nuclear cccDNA minichromosome. J Clin Invest 2012;122:529-37.
- Li K, Chen Z, Kato N, et al. Distinct poly(I-C)and virus-activated signaling pathways leading to interferon-beta production in hepatocytes. J Biol Chem 2005;280:16739-47.
- Tnani M, Bayard BA. Evidence for IRF-1-dependent gene expression deficiency in interferon unresponsive HepG2 cells. Biochim Biophys Acta 1999;1451:59-72.
- Ignatius Irudayam J, Contreras D, Spurka L, et al. Characterization of type I interferon pathway during hepatic differentiation of human pluripotent stem cells and hepatitis C virus infection. Stem Cell Res 2015;15:354-64.
- Shlomai A, Schwartz RE, Ramanan V, et al. Modeling host interactions with hepatitis B virus using primary and induced pluripotent stem cell-derived hepatocellular systems. Proc Natl Acad Sci U S A 2014;111:12193-8.
- Si-Tayeb K, Noto FK, Nagaoka M, et al. Highly efficient generation of human hepatocyte-like cells from induced pluripotent stem cells. Hepatology 2010;51:297-305.










